Hvad betyder udsagnet, at et atom eller ioner er isoelektronisk med en ædel gas?
Her er en sammenbrud:
* ædle gasser er elementerne i gruppe 18 i den periodiske tabel (He, NE, AR, KR, XE, RN). De er kendt for deres stabilitet og manglende reaktivitet på grund af at have en fuld ydre skal af elektroner.
* Elektronkonfiguration Beskriver arrangementet af elektroner i et atoms orbitaler.
* isoelektronisk betyder at have det samme antal elektroner.
Hvordan sker dette?
Atomer kan vinde eller miste elektroner for at opnå en stabil, ædelgaskonfiguration. Denne proces er kendt som ionisering , og det kan skabe ioner (ladede atomer).
Eksempler:
* natrium (NA) Har en elektron i sin yderste skal. Ved at miste denne elektron bliver det en natriumion (Na+) med den samme elektronkonfiguration som neon (NE) . Derfor er Na+ isoelektronisk med NE.
* klor (Cl) Har syv elektroner i sin yderste skal. Ved at få en elektron bliver det en chloridion (Cl-) med den samme elektronkonfiguration som argon (AR) . Derfor er cl- isoelectronic med AR.
Nøglepunkter:
* Isoelektroniske arter har det samme antal elektroner og den samme elektronkonfiguration.
* Atomer eller ioner, der er isoelektroniske med ædelgasser, er typisk mere stabile.
* Dette koncept er vigtigt for at forstå kemisk binding og reaktiviteten af elementer.
Ved at forstå begrebet isoelektroniske arter kan vi bedre forudsige, hvordan atomer vil interagere og danne forbindelser.
Sidste artikelHvad må der være sket med et calciumatom for det at opnå ædle gasstruktur?
Næste artikelEr AR et atom eller molekyle?
 Varme artikler
Varme artikler
-
 Discovery lyser vej til Alzheimers -forskningEt rheniumbaseret kompleks udviklet ved Rice University binder sig til fibriller af forkert foldet amyloid beta-peptid, som markerer placeringen af en hydrofob spalte, der kan tjene som et lægemidde
Discovery lyser vej til Alzheimers -forskningEt rheniumbaseret kompleks udviklet ved Rice University binder sig til fibriller af forkert foldet amyloid beta-peptid, som markerer placeringen af en hydrofob spalte, der kan tjene som et lægemidde -
 Spædningseffekt forårsaget af rodstrøelse varierer med rodrækkefølgenGrafisk abstrakt. Kredit:DOI:10.1016/j.soilbio.2021.108354 Planteaffald kan påvirke jordens organiske kulstofdynamik via priming-effekten, som defineres som ændringer i jordens organiske kulstofne
Spædningseffekt forårsaget af rodstrøelse varierer med rodrækkefølgenGrafisk abstrakt. Kredit:DOI:10.1016/j.soilbio.2021.108354 Planteaffald kan påvirke jordens organiske kulstofdynamik via priming-effekten, som defineres som ændringer i jordens organiske kulstofne -
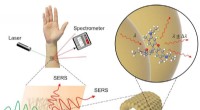 En ny Raman kemisk sensor lavet af nudellignende tråde af guldSERS, eller overfladeforstærket Raman-spektroskopi, er en metode til at detektere tilstedeværelsen af et kemikalie indirekte ved at bruge laserlys og en specialiseret sensor. Guldnettet giver en ide
En ny Raman kemisk sensor lavet af nudellignende tråde af guldSERS, eller overfladeforstærket Raman-spektroskopi, er en metode til at detektere tilstedeværelsen af et kemikalie indirekte ved at bruge laserlys og en specialiseret sensor. Guldnettet giver en ide -
 Ny metodologi hjælper med at studere lovende målrettet lægemiddelleveringsstilladsForskere undersøgte, hvor mutationer var tilladt i den fodbold-lignende struktur lavet af MS2-stilladset. Kredit:Northwestern University Northwestern Engineering-forskere har udviklet en ny måde a
Ny metodologi hjælper med at studere lovende målrettet lægemiddelleveringsstilladsForskere undersøgte, hvor mutationer var tilladt i den fodbold-lignende struktur lavet af MS2-stilladset. Kredit:Northwestern University Northwestern Engineering-forskere har udviklet en ny måde a
- Hvad producenten betyder på din videnskabsmesse?
- Indfangning af sort guld med lys
- Hvad er forholdet mellem placering af fold bjerg- og pladegrænser?
- Bekæmpelse af Parkinsons med kulstofnanopartikler
- Hvorfor udvikler der sig dampe, når en flaske saltsyre åbnes?
- Over en fjerdedel af mennesker siger, at deres liv er meget anderledes nu sammenlignet med før COVI…


