Ny metodologi hjælper med at studere lovende målrettet lægemiddelleveringsstillads
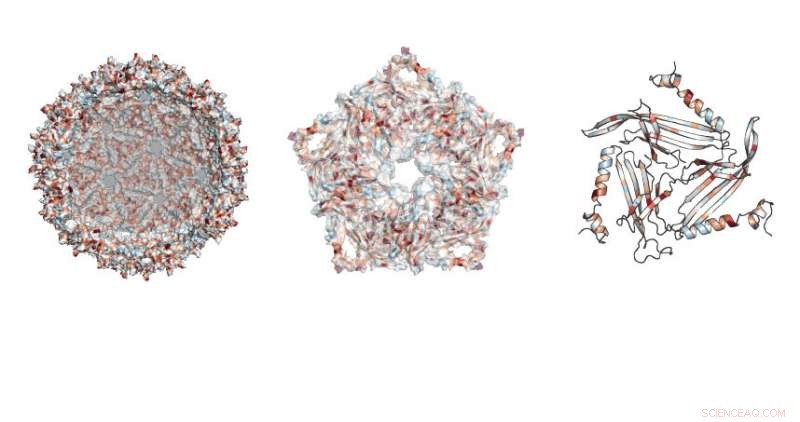
Forskere undersøgte, hvor mutationer var tilladt i den fodbold-lignende struktur lavet af MS2-stilladset. Kredit:Northwestern University
Northwestern Engineering-forskere har udviklet en ny måde at manipulere en virusskal, der samler sig selv fra proteiner og lover som en bærer til sygdomsdetektion, medicin levering, og vaccinationer.
Virus har skaller, der er bygget til at overleve under barske forhold, beskytte deres last, indtil de finder en celle at inficere. Skallen kan bruges til gode, imidlertid, fordi den stabilitet gør den velegnet til at beskytte mere nyttig last, såsom medicin, som kan leveres til specifikt målrettede celler.
Forskningen fokuserede på et protein, der bruges af en bakterievirus kaldet MS2-bakteriofagen. Dette protein kan selv samle, skabe et harmløst stillads ud af den virale skal, sagde Danielle Tullman-Ercek, lektor i kemisk og biologisk ingeniørvidenskab ved McCormick School of Engineering.
"I biologi, alt har sin plads. Biologi er sådan fantastisk - bortset fra at vi ikke kender reglerne, " sagde Tullman-Ercek. "Vores opdagelse var metoden til at bestemme disse designregler."
Studiet, udført i samarbejde med kemiprofessor Matthew Francis og hans kolleger ved University of California i Berkeley, tog mere end to år. Resultaterne blev offentliggjort den 11. april i tidsskriftet Naturkommunikation .
Arbejdet gjorde det muligt for forskerne at undersøge, hvilke specifikke proteinmutationer, der knækkede virusstilladset eller ændrede strukturens egenskaber. At gøre det, holdet udviklede en ny teknik kaldet SyMAPS (Systematic Mutation and Assembled Particle Selection), som adskilte de muterede stilladsproteiner, der forblev intakte, fra dem, der gik i stykker under mutationen.
I alt, holdet testede næsten 2, 600 versioner af proteinet, som udgør den lukkede skal, fodbold-lignende stillads.
"MS2 stilladsproteinet har 129 positioner, hvor vi kan foretage en substitution, at erstatte den eksisterende aminosyre i den position med alle andre aminosyrer, " sagde Emily Hartman, en fjerdeårs ph.d.-kandidat i kemi ved UC Berkeley og hovedforfatter på papiret. "Ved at bytte alle 20 naturligt forekommende aminosyrer, en ad gangen, på hver position i proteinet, vi ender med at teste 20 variable på 129 positioner."
Holdet mener, at forståelsen af, hvordan mutationer ændrer stilladset, giver vigtig indsigt i, hvordan disse genbrugte virusproteiner kan bruges i medicin.
"Det stillads, du vil have til lægemiddellevering, kan være anderledes end det, du ønsker til en vaccine, " sagde Tullman-Ercek. "Vi vil måske ændre egenskaberne for ladning på overfladen for at få bedre målretning eller tilføje noget til indersiden af strukturen, som at indlæse den med en sensor eller diagnostisk optager."
For eksempel, en struktur, der falder fra hinanden i et specifikt miljø, kunne hjælpe med målrettet medicinafgivelse, såsom kemoterapi.
"En af de ting, vi gjorde i undersøgelsen, var at lede efter mutanter, der er følsomme over for syre, " sagde Hartman. "Blodbanen er ikke sur, men en gang inde i en kræftcelle, det er meget mere surt. Hvis stilladset falder fra hinanden i sure miljøer, det ville nemmere frigive stoffet inde i en kræftcelle."
En struktur mindre tolerant over for sure forhold blev fundet, og teamet vil fortsætte arbejdet på dette område.
Ud over, undersøgelsen giver indsigt i, hvad der naturligt kan opstå i en muterende virus, såsom influenza. "Dette kunne give os en idé om, hvilke steder i virussen der kunne have en højere mutationsrate. Den information kunne bruges af videnskabsmænd til at udvikle nye vacciner, " sagde Tullman-Ercek.
Teamet og deres kolleger på begge universiteter vil bruge arbejdet som grundlag for specifikke applikationer til det virale stillads, hun sagde.
"Dette papir er virkelig et første skridt i et større sæt historier, " sagde Hartman. "Der er en masse løbende arbejde i dette samarbejde mellem universiteterne. Jeg er spændt på at se, hvor det går hen.
Undersøgelsen bygger på Tullman-Erceks tidligere arbejde, som fandt ud af, at en enkelt aminosyremutation i det samme MS2-bakteriofagstillads drastisk ændrede dens størrelse.
Tullman-Ercek tjener som fakultetsmedlem i Northwesterns Center for Synthetic Biology. Det to år gamle center samler forskere fra ingeniørvidenskab, medicin, fysik, og datalogi interesseret i at manipulere biologi for at hjælpe samfundet. Meget af syntetisk biologi fokuserer på at ændre en celle ved at ændre dens DNA, skabe nye specialiserede produkter.
 Varme artikler
Varme artikler
-
 At opnå stærke strukturer med kulfiberforstærket plastEn fejl på grund af den klassiske globale knækning af søjlen med begge endestifter opleves af den ustyrkede kontrolprøve, (en). Sammenlignet med formen af kontrolprøverne, den deformerede form af al
At opnå stærke strukturer med kulfiberforstærket plastEn fejl på grund af den klassiske globale knækning af søjlen med begge endestifter opleves af den ustyrkede kontrolprøve, (en). Sammenlignet med formen af kontrolprøverne, den deformerede form af al -
 Forskere skaber fermenteret juice og funktionelt brød til behandling af anæmiKredit:South Ural State University (SUSU) Et team af russiske forskere fra South Ural State University og deres egyptiske kolleger fremstiller sunde funktionelle fødevarer. Brød og drikkevarer rig
Forskere skaber fermenteret juice og funktionelt brød til behandling af anæmiKredit:South Ural State University (SUSU) Et team af russiske forskere fra South Ural State University og deres egyptiske kolleger fremstiller sunde funktionelle fødevarer. Brød og drikkevarer rig -
 Stikkende smagsstof i ingefær reducerer dårlig åndeKredit:CC0 Public Domain Den skarpe forbindelse 6-gingerol, en bestanddel af ingefær, stimulerer et enzym i spyt, der nedbryder ildelugtende stoffer. Det sikrer dermed frisk ånde og en bedre efter
Stikkende smagsstof i ingefær reducerer dårlig åndeKredit:CC0 Public Domain Den skarpe forbindelse 6-gingerol, en bestanddel af ingefær, stimulerer et enzym i spyt, der nedbryder ildelugtende stoffer. Det sikrer dermed frisk ånde og en bedre efter -
 Forskere er pionerer på en grønnere måde at skabe sammenvævede polymerer med blåt lysUniversity of Delaware forskere lavede universitetets logo ved hjælp af deres nyudviklede polymerisationsteknik. Kredit:Abhishek Shete/ University of Delaware Et par ingeniører ved University of D
Forskere er pionerer på en grønnere måde at skabe sammenvævede polymerer med blåt lysUniversity of Delaware forskere lavede universitetets logo ved hjælp af deres nyudviklede polymerisationsteknik. Kredit:Abhishek Shete/ University of Delaware Et par ingeniører ved University of D
- Ny opdagelse for at fremskynde udviklingen af salttolerante vinstokke
- NASAs asteroidejager svinger forbi Jorden på vej til rumsten
- Bering Havisudbredelse er højst reduceret i de sidste 5, 500 år
- 20-årigt felteksperiment:Roter majs for bedre jordsundhed
- Gamle huleaflejringer afslører vores klimafremtid
- En potentiel model for et rigtigt fysisk kædeled


