Forklar kemiske ligevægtsskift for at favorisere produkter?
skiftende ligevægten for at favorisere produkter:
Kemisk ligevægt er en dynamisk tilstand, hvor hastighederne for de fremadgående og omvendte reaktioner er ens, hvilket resulterer i ingen nettoændring i koncentrationerne af reaktanter og produkter. Imidlertid kan denne ligevægt forskydes til at favorisere produktdannelse ved at anvende visse betingelser, kendt som le Chateliers princip .
le Chateliers princip siger:
*Hvis der anvendes en ændring af betingelsen på et system i ligevægt, skifter systemet i en retning, der lindrer stresset.*
Her er betingelserne, der kan flytte ligevægten til at favorisere produkter:
1. Tilføjelse af flere reaktanter:
* stress: Øget koncentration af reaktanter.
* skift: Ligevægten skifter til højre, forbruger de tilsatte reaktanter og producerer flere produkter for at lindre stresset.
2. Fjernelse af produkter:
* stress: Nedsat koncentration af produkter.
* skift: Ligevægten skifter til højre og producerer flere produkter for at genopfylde de fjernede og gendanne ligevægten.
3. Stigende temperatur:
* stress: Øget temperatur.
* skift: For endotermiske reaktioner (Varmen absorberes som reaktant), ligevægten skifter til højre og favoriserer produkterne og forbruger varme. For eksotermiske reaktioner (Heat frigøres som et produkt), ligevægten skifter til venstre, favoriserer reaktanterne og frigiver varme.
4. Faldende temperatur:
* stress: Nedsat temperatur.
* skift: For endotermiske reaktioner , ligevægten skifter til venstre, favoriserer reaktanterne og frigiver varme. For eksotermiske reaktioner , ligevægten skifter til højre og favoriserer produkterne og absorberer varme.
5. Stigende pres:
* stress: Øget tryk.
* skift: Ligevægten skifter til siden med færre mol gas for at lindre trykket. For reaktioner, der involverer gasser, hvis produktsiden har færre mol gas end reaktantsiden, vil ligevægten skifte til højre.
6. Faldende pres:
* stress: Nedsat pres.
* skift: Ligevægten skifter til siden med mere mol gas for at øge trykket. Hvis produktsiden har mere mol gas end reaktantsiden, skifter ligevægten til højre.
7. Tilføjelse af en katalysator:
* stress: Tilføjelse af en katalysator.
* skift: En katalysator fremskynder både de fremadgående og omvendte reaktioner lige, hvilket fører til hurtigere opnåelse af ligevægt, men ikke et skift i ligevægtens position. Det favoriserer hverken produkter eller reaktanter.
Sammenfattende kan du ved at anvende disse forhold manipulere ligevægten af en reaktion på at producere mere ønskede produkter.
Bemærk: I hvilket omfang ligevægtsskift afhænger af den specifikke reaktion og størrelsen af ændringen i tilstand.
 Varme artikler
Varme artikler
-
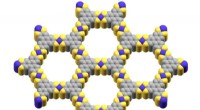 En ny miniatureløsning til lagring af vedvarende energiDen kobolt-baserede metal-organiske ramme brugt af USC-forskerne, med lilla, der repræsenterer kobolt, gul repræsenterer svovl og grå repræsenterer kulstof. Kredit:Smaranda Marinescu Forskere har
En ny miniatureløsning til lagring af vedvarende energiDen kobolt-baserede metal-organiske ramme brugt af USC-forskerne, med lilla, der repræsenterer kobolt, gul repræsenterer svovl og grå repræsenterer kulstof. Kredit:Smaranda Marinescu Forskere har -
 Afkodning af de grundlæggende mekanismer for menneskelig spytsmøringKredit:CC0 Public Domain Et tværfagligt team af forskere ledet af University of Leeds har afsløret den grundlæggende mekanisme, hvorved menneskets spyt smører vores mund. Deres multi-skala undersø
Afkodning af de grundlæggende mekanismer for menneskelig spytsmøringKredit:CC0 Public Domain Et tværfagligt team af forskere ledet af University of Leeds har afsløret den grundlæggende mekanisme, hvorved menneskets spyt smører vores mund. Deres multi-skala undersø -
 Fremstilling af mikrober, der omdanner drivhusgasserUSF-forsker Alex Chou manipulerer DNA for at konstruere E. coli til C1-konvertering. Kredit:University of South Florida Forskere ved University of South Florida udnytter kraften i den menneskelige
Fremstilling af mikrober, der omdanner drivhusgasserUSF-forsker Alex Chou manipulerer DNA for at konstruere E. coli til C1-konvertering. Kredit:University of South Florida Forskere ved University of South Florida udnytter kraften i den menneskelige -
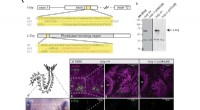 Lysfølsomt molekyle hjælper havdyr med at synkronisere deres reproduktionscyklusl-cry–/– mutanter er alleler med tab af funktion. en oversigt over det genomiske l-cry-locus for wt og mutanter. Begge mutante alleler resulterer i et tidligt rammeskift og for tidlige stopkodoner. Δ3
Lysfølsomt molekyle hjælper havdyr med at synkronisere deres reproduktionscyklusl-cry–/– mutanter er alleler med tab af funktion. en oversigt over det genomiske l-cry-locus for wt og mutanter. Begge mutante alleler resulterer i et tidligt rammeskift og for tidlige stopkodoner. Δ3
- Større skader på mobilhomeparken i Alabama midt i en tropisk storm
- Lærerretssager over tvungen karakterinflation vil ikke løse unfair karakterer – her er hvad der ku…
- Hvad fortæller fossiler os om det levende, der er fossiliseret?
- Hvordan blomster opretholder vandbalancen på tværs af forskellige angiosperm-grene
- Hvorfor er Cumulonimbus -skyer mere tilbøjelige til at danne sig på en solskinsdag?
- Flydende vand er begravet under Mars landskab, siger undersøgelse


