Hvorfor kaldes vand det universelle opløsningsmiddel Hvad har polaritet at gøre med dette?
Nøglen til vandets opløste kraft ligger i dens polaritet . Sådan fungerer det:
* Polaritet: Vandmolekyler er bøjet, hvor iltatomet er lidt negative, og brintatomerne er lidt positive. Denne ujævne fordeling af ladning gør vand til et polært molekyle .
* attraktion: Når et polært molekyle som vand møder et andet polært molekyle eller en ionisk forbindelse, tiltrækker de modsatte ladninger. Den positive ende af vandmolekylet tiltrækker den negative ende af det andet molekyle, og vice versa.
* opløste: Denne attraktion kan overvinde kræfterne, der holder det andet stof sammen, hvilket får det til at gå i stykker og blive omgivet af vandmolekyler. Dette er processen med at opløse.
Eksempler:
* salt (NaCl): Når salt opløses i vand, tiltrækkes de positive natriumioner (Na+) af den negative iltende ende af vandmolekyler, mens de negative chloridioner (Cl-) tiltrækkes af de positive brintender. Dette svækker de ioniske bindinger i saltkrystallen, så den kan opløses.
* sukker (C12H22O11): Sukker er et polært molekyle med mange iltatomer. Oxygenatomerne i sukker kan danne brintbindinger med brintatomer i vand, hvilket fører til dets opløsning.
Ikke-polære stoffer og vand:
Ikke-polære stoffer som olier og fedt har en jævn fordeling af ladning. De tiltrækkes ikke af de polære vandmolekyler og opløses derfor ikke i vand. Dette er grunden til, at olie og vand adskilles.
Sammenfattende er Water's polaritet nøglefaktoren i dens evne til at opløse mange stoffer. De positive og negative ender af vandmolekyler tiltrækker og interagerer med andre polære molekyler og ioniske forbindelser, nedbryder dem og får dem til at opløses.
Sidste artikelHvorfor er formen på et vandmolekyle tetrahedron?
Næste artikelHvad er Snowflake Chemical Compound?
 Varme artikler
Varme artikler
-
 Vedvarende energi kan reducere udstødningsemissioner drastiskEn kompleks opsætning af objektiver og kameraer er påkrævet for direkte, laserbaserede NOx-målinger i en flamme. Kredit:© 2018 Miles Bohon Skift til vedvarende brændstoffer kan reducere udstødning
Vedvarende energi kan reducere udstødningsemissioner drastiskEn kompleks opsætning af objektiver og kameraer er påkrævet for direkte, laserbaserede NOx-målinger i en flamme. Kredit:© 2018 Miles Bohon Skift til vedvarende brændstoffer kan reducere udstødning -
 Undersøgelse skyller hudenKAUST-forskere har brugt komplementære teknikker til at adskille rent grænsefladeeffekter fra elektrospray-specifikke effekter. Kredit:Ivan Gromicho Fra den vindpiskede overflade af det åbne hav,
Undersøgelse skyller hudenKAUST-forskere har brugt komplementære teknikker til at adskille rent grænsefladeeffekter fra elektrospray-specifikke effekter. Kredit:Ivan Gromicho Fra den vindpiskede overflade af det åbne hav, -
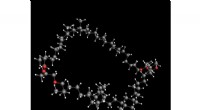 Syntese af et af de mest rigelige organiske lipider belyser dets strukturEn 3D-gengivelse af strukturen af crenarchaeol. Kredit:Adri Minnaard, Universitetet i Groningen Crenarchaeol er en stor, lipid med lukket kredsløb, der er til stede i membranerne af ammoniumoxid
Syntese af et af de mest rigelige organiske lipider belyser dets strukturEn 3D-gengivelse af strukturen af crenarchaeol. Kredit:Adri Minnaard, Universitetet i Groningen Crenarchaeol er en stor, lipid med lukket kredsløb, der er til stede i membranerne af ammoniumoxid -
 En ny idé forbinder syntesen af ler og stofskiftets oprindelseIllustration, der forbinder syntesen af lerarter og metabolismens oprindelse. Kredit:Ruixin Zhou Spørgsmålet om, hvordan livet er begyndt, har fascineret forskere fra mange discipliner, og det v
En ny idé forbinder syntesen af ler og stofskiftets oprindelseIllustration, der forbinder syntesen af lerarter og metabolismens oprindelse. Kredit:Ruixin Zhou Spørgsmålet om, hvordan livet er begyndt, har fascineret forskere fra mange discipliner, og det v
- Hvordan forholdet mellem biodiversitet og produktivitet ændrer sig langs højden i skovene
- 3-D-printede batterier klarer presset
- Forskellene i skove, skove og jungler
- Hvordan kan din fortælling hat oxidere i en redoxreaktion?
- Mars-støv som grundlag for liv? Intet problem for visse bakterier
- Hvor mange centimeter i 32 tommer?


