Hvor mange obligationer kan kulstof dannes med sig selv?
Her er hvorfor:
* Valenselektroner: Carbon har fire valenselektroner, hvilket betyder, at det kan danne fire bindinger.
* Stærke obligationer: Bindingerne kulstofformer med sig selv (C-C-obligationer) er meget stærke.
* forskellige binding: Carbon kan danne enkelt-, dobbelt- og tredobbeltbindinger med sig selv.
Denne evne til at danne lange kæder og komplekse strukturer er grundlaget for den enorme mangfoldighed af organiske molekyler, herunder:
* kulbrinter: Kæder og ringe af carbonatomer bundet til brint.
* polymerer: Lange kæder med gentagne enheder.
* Proteiner: Komplekse molekyler sammensat af aminosyrer forbundet sammen.
* DNA og RNA: Genetisk materiale, der indeholder en kompleks struktur af sammenkoblede carbonatomer.
Så selvom kulstof kan danne fire bindinger med andre atomer, skaber dens evne til at binde sig uendeligt med et næsten uendeligt antal muligheder.
Sidste artikelHvad forhindrer hydrogenbindinger mellem baser?
Næste artikelHvorfor er formen på et vandmolekyle tetrahedron?
 Varme artikler
Varme artikler
-
 Brug af radikaliserede NOₓ-derivater understøttet på metaloxiderGrafisk billede af forskningen. Kredit:Korea Institute of Science and Technology (KIST) INGEN x (X=1 eller 2), der udsendes fra papirvarer/mobilkilder, anses traditionelt for at være berygtede,
Brug af radikaliserede NOₓ-derivater understøttet på metaloxiderGrafisk billede af forskningen. Kredit:Korea Institute of Science and Technology (KIST) INGEN x (X=1 eller 2), der udsendes fra papirvarer/mobilkilder, anses traditionelt for at være berygtede, -
 Forskere udvikler solid-state, fritstående carbon nanofiber superkondensatorDrexel-forskere har udviklet en solid-state, fritstående elektrode, der kan gøre energilagringsenheder sikrere ved at fjerne deres brændbare elektrolytopløsning. Elektroden bruger en kulfibermåtte, la
Forskere udvikler solid-state, fritstående carbon nanofiber superkondensatorDrexel-forskere har udviklet en solid-state, fritstående elektrode, der kan gøre energilagringsenheder sikrere ved at fjerne deres brændbare elektrolytopløsning. Elektroden bruger en kulfibermåtte, la -
 Lille tornado øger ydeevnen af elektrospray-ioniseringsmassespektrometriDRILL-enheden er forbundet til et massespektrometer for at sortere ladede dråber og forbedre desolvation af ioniserede biomolekyler til analyse. Enheden kræver ingen ændring af massespektrometeret, og
Lille tornado øger ydeevnen af elektrospray-ioniseringsmassespektrometriDRILL-enheden er forbundet til et massespektrometer for at sortere ladede dråber og forbedre desolvation af ioniserede biomolekyler til analyse. Enheden kræver ingen ændring af massespektrometeret, og -
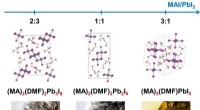 Forskere foreslår metode til at øge effektiviteten af solcellebatterierKrystalstrukturer af krystallinske solvater. Kredit:Alexey Tarasov Forskere fra Institut for Materialevidenskab, Lomonosov MSU, har bestemt, hvordan ændring af forholdet mellem komponenter, der da
Forskere foreslår metode til at øge effektiviteten af solcellebatterierKrystalstrukturer af krystallinske solvater. Kredit:Alexey Tarasov Forskere fra Institut for Materialevidenskab, Lomonosov MSU, har bestemt, hvordan ændring af forholdet mellem komponenter, der da


