Hvilket af følgende er et polært molekyle F2 CO2 PF3 CF4 eller BF3?
Forståelse af polaritet
* polære molekyler Har en ujævn fordeling af elektrondensitet, hvilket resulterer i en positiv og negativ ende (et dipolmoment). Dette sker, når der er en forskel i elektronegativitet mellem atomerne i molekylet.
* ikke -polære molekyler har en jævn fordeling af elektrondensitet.
analyse af molekylerne
* f2 (fluor) :Dette er et diatomisk molekyle med identiske fluoratomer. Elektronegativitet er den samme på begge sider, så molekylet er ikke -polær .
* CO2 (kuldioxid) :Mens ilt er mere elektronegativt end kulstof, er molekylet lineært. De to polære bindinger (C =O) er symmetriske og annullerer hinanden. Derfor er CO2 ikke -polær .
* PF3 (fosfor trifluorid) :Fosfor er mindre elektronegativ end fluor. De tre P-F-bindinger skaber en trigonal pyramidal form med en ujævn fordeling af elektrondensitet, hvilket gør PF3 polar .
* CF4 (carbon tetrafluorid) :Carbon er mindre elektronegativ end fluor. Imidlertid er de fire C-F-bindinger arrangeret symmetrisk i en tetrahedral form. Denne symmetri annullerer de individuelle obligationspolariteter, hvilket gør CF4 ikke -polær .
* bf3 (bortrifluorid) :Bor er mindre elektronegativ end fluor. De tre B-F-bindinger er arrangeret i en trigonal plan form. Mens de enkelte obligationer er polære, er de symmetriske og annullerer hinanden. Derfor er BF3 ikke -polær .
Konklusion
Det eneste polære molekyle fra listen er PF3 (fosfortrifluorid) .
Sidste artikelEr C6H5CO2NA polar eller ikke polær?
Næste artikelHvilket molekyle er et polært binding, men ikke molekyle?
 Varme artikler
Varme artikler
-
 Lovende ny soldrevet vej til brintbrændstofproduktionLeah C. Spangler udfører et eksperiment i Lehighs Health Research Hub. Kredit:Ryan Hulvat Ingeniører ved Lehigh University er de første til at udnytte en enkelt enzym biomineraliseringsproces til
Lovende ny soldrevet vej til brintbrændstofproduktionLeah C. Spangler udfører et eksperiment i Lehighs Health Research Hub. Kredit:Ryan Hulvat Ingeniører ved Lehigh University er de første til at udnytte en enkelt enzym biomineraliseringsproces til -
 Forskere afslører kritisk metabolisk switch for inflammatoriske sygdommeKredit:CC0 Public Domain Et forskerhold i Trinity College Dublin har afsløret en kritisk rolle for et protein kaldet PKM2 i reguleringen af immuncelletyper i hjertet af flere inflammatoriske syg
Forskere afslører kritisk metabolisk switch for inflammatoriske sygdommeKredit:CC0 Public Domain Et forskerhold i Trinity College Dublin har afsløret en kritisk rolle for et protein kaldet PKM2 i reguleringen af immuncelletyper i hjertet af flere inflammatoriske syg -
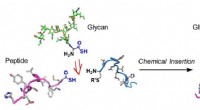 En vindende kombination til glykoproteinsynteseGlycoproteinsyntese ved kemisk indsættelse ved hjælp af en thiosyremedieret strategi:Metoden samler et fuldt glycoproteinsegment i to trin. Kredit:Osaka University Mange processer i kroppen regule
En vindende kombination til glykoproteinsynteseGlycoproteinsyntese ved kemisk indsættelse ved hjælp af en thiosyremedieret strategi:Metoden samler et fuldt glycoproteinsegment i to trin. Kredit:Osaka University Mange processer i kroppen regule -
 NIST går med det (langsomme) flow:Ny teknik kan forbedre bioteknologien, præcisionsmedicinForskere ved National Institute of Standards and Technology (NIST) har udviklet et optisk system, der nøjagtigt måler strømmen af ekstraordinært små mængder væske - så små som 10 milliardtedele lite
NIST går med det (langsomme) flow:Ny teknik kan forbedre bioteknologien, præcisionsmedicinForskere ved National Institute of Standards and Technology (NIST) har udviklet et optisk system, der nøjagtigt måler strømmen af ekstraordinært små mængder væske - så små som 10 milliardtedele lite
- Forskere syntetiserer halvmetal uden magnetisering
- Hvorfor ser græs ud for os at bruge udtryk reflekterer og absorberer i dette svar?
- Ingeniører udvikler højtydende og højpålidelig kunstig synaptisk halvlederenhed
- Er super-Jorden faktisk mini-Neptunes?
- Boeing gentager testflyvning af ubemandet Starliner-rumskib
- Hvid grafen udviser høj defekttolerance og elasticitet


