Hvordan ændres hydrogenionkoncentrationen, når pH ændrer sig?
* Når pH øges, falder hydrogenionkoncentrationen.
* Når pH falder, øges hydrogenionkoncentrationen.
Her er en mere detaljeret forklaring:
* ph er et mål for surhedsgraden eller alkaliniteten af en opløsning. Det er defineret som den negative logaritme (base 10) af hydrogenionkoncentrationen:
ph =-log10 [H+]
* [H+] er koncentrationen af brintioner i mol pr. Liter (mol/L).
Lad os se på nogle eksempler:
* En opløsning med en pH på 7 er neutral. Dette betyder, at hydrogenionkoncentrationen er 10^-7 mol/l.
* En opløsning med en pH på 1 er meget sur. Dette betyder, at hydrogenionkoncentrationen er 10^-1 mol/l.
* En opløsning med en pH på 13 er meget alkalisk. Dette betyder, at hydrogenionkoncentrationen er 10^-13 mol/l.
Kortfattet:
* En lavere pH indikerer en højere hydrogenionkoncentration (mere sur).
* En højere pH indikerer en lavere hydrogenionkoncentration (mere alkalisk).
Dette forhold er vigtigt i mange kemiske og biologiske processer, da det påvirker egenskaberne og opførslen af forskellige stoffer.
 Varme artikler
Varme artikler
-
 Forskere gør vigtige fremskridt for at printe kredsløb på bærbare stofferPerovskite struktur. Kredit:OSU College of Engineering Elektroniske skjorter, der holder brugeren behagelig varm eller kølig, såvel som medicinske stoffer, der leverer lægemidler, overvåge tilstan
Forskere gør vigtige fremskridt for at printe kredsløb på bærbare stofferPerovskite struktur. Kredit:OSU College of Engineering Elektroniske skjorter, der holder brugeren behagelig varm eller kølig, såvel som medicinske stoffer, der leverer lægemidler, overvåge tilstan -
 Forskere forvandler akvakulturaffald til nyt biomateriale til vævsreparationForskerne mener, at biomaterialet er et lovende alternativ til den nuværende standardpraksis med at bruge en patients eget væv, hvilket kræver yderligere operation til knogleudtrækning. På samme tid,
Forskere forvandler akvakulturaffald til nyt biomateriale til vævsreparationForskerne mener, at biomaterialet er et lovende alternativ til den nuværende standardpraksis med at bruge en patients eget væv, hvilket kræver yderligere operation til knogleudtrækning. På samme tid, -
 Forskere i verden afslører først strukturen af et vigtigt lægemiddelmålKredit:Monash University Monash University-forskere har brugt en ny teknik til at afsløre strukturen af et vigtigt lægemiddelmål, åbner vejen for forbedrede behandlinger af kroniske sygdomme som
Forskere i verden afslører først strukturen af et vigtigt lægemiddelmålKredit:Monash University Monash University-forskere har brugt en ny teknik til at afsløre strukturen af et vigtigt lægemiddelmål, åbner vejen for forbedrede behandlinger af kroniske sygdomme som -
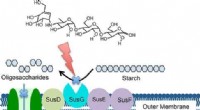 Præcis målretningsteknik kunne regulere tarmbakterier, begrænsende sygdomKredit:American Chemical Society Nye beviser tyder på, at mikrober i fordøjelsessystemet har stor indflydelse på menneskers sundhed og kan spille en rolle i starten af sygdom i hele kroppen. Nu,
Præcis målretningsteknik kunne regulere tarmbakterier, begrænsende sygdomKredit:American Chemical Society Nye beviser tyder på, at mikrober i fordøjelsessystemet har stor indflydelse på menneskers sundhed og kan spille en rolle i starten af sygdom i hele kroppen. Nu,
- Hvordan virker tandblegning
- Hvis du rejste i en lige linje fra San Diego Californien til Mexico City, ville der passere gennem b…
- Hvordan kan formørkelsen potentielt skade dine øjne, og hvilke forholdsregler skal der tages for a…
- Hvad sociale medier kan lære os om forhold mellem menneske og miljø
- Faster alle økosystemer de generelle træk til at overleve?
- Er Jupiter den første anden tredje fjerde femte femte seks eller syvende planet fra Sun?


