Hvad er den moderne elektronkonfiguration af svovl?
1S² 2S² 2P⁶ 3S² 3P⁴
Sådan forstår du det:
* 1S²: Det første energiniveau (n =1) har et sublevel, 'S' -udlysningen, der kan holde op til 2 elektroner.
* 2s²: Det andet energiniveau (n =2) har to subles, 'S' og 'P'. 'S' Sublevel har 2 elektroner.
* 2p⁶: 'P' -udlysningen i det andet energiniveau kan indeholde op til 6 elektroner.
* 3S²: Det tredje energiniveau (n =3) har to subles, 'S' og 'P'. 'S' Sublevel har 2 elektroner.
* 3p⁴: 'P' -udlysningen i det tredje energiniveau har 4 elektroner.
Vigtig note: Dette er jordtilstandens elektronkonfiguration. Svovl kan have forskellige elektronkonfigurationer, når det danner ioner eller ophidsede tilstande.
Sidste artikelHvilke giftige kemikalier er i kopipapir?
Næste artikelHvad er den vandige væske, der begynder kemisk sammenbrud af mad?
 Varme artikler
Varme artikler
-
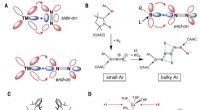 Forskere finder overraskende bindinger af overgangsmetal-typen, mens de bygger nye calcium(I)-komple…Nitrogenaktivering med overgangsmetaller (TM) eller bor og eksempler på lavvalente AE-metalkomplekser. Kredit: Videnskab (2021). DOI:10.1126/science.abf2374 Et team af forskere fra University Erl
Forskere finder overraskende bindinger af overgangsmetal-typen, mens de bygger nye calcium(I)-komple…Nitrogenaktivering med overgangsmetaller (TM) eller bor og eksempler på lavvalente AE-metalkomplekser. Kredit: Videnskab (2021). DOI:10.1126/science.abf2374 Et team af forskere fra University Erl -
 Små børster, der gør overflader glatte, fungerer muligvis ikke efter hensigten, undersøgelse fin…I rent vand, disse små molekylære børster står lige op og bevarer en glat overflade. Men tilføjelse af ioner med +2 og +3 ladninger får dem til at klumpe og miste deres glathed (ovenfor). Kredit:Yu et
Små børster, der gør overflader glatte, fungerer muligvis ikke efter hensigten, undersøgelse fin…I rent vand, disse små molekylære børster står lige op og bevarer en glat overflade. Men tilføjelse af ioner med +2 og +3 ladninger får dem til at klumpe og miste deres glathed (ovenfor). Kredit:Yu et -
 Sølv forbedrer effektiviteten af solceller i monokornlagNæste generations letvægts, fleksible monograin-lagsolcelle udviklet af TalTech-forskere. Kredit:Professor Jüri Krustok Som et resultat af deres toårige fælles projekt, materialeforskerne fra Tall
Sølv forbedrer effektiviteten af solceller i monokornlagNæste generations letvægts, fleksible monograin-lagsolcelle udviklet af TalTech-forskere. Kredit:Professor Jüri Krustok Som et resultat af deres toårige fælles projekt, materialeforskerne fra Tall -
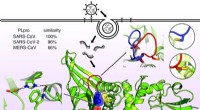 Information om molekylær form af vira, der forårsager COVID-19, SARS, og MERS afslører strukturel…Molekylær struktur af det papainlignende enzym kendt som PLPro. Dette enzym tillader de vira, der forårsager SARS, MERS, og COVID-19 for at inficere celler og replikere og undertrykke værtens immunfun
Information om molekylær form af vira, der forårsager COVID-19, SARS, og MERS afslører strukturel…Molekylær struktur af det papainlignende enzym kendt som PLPro. Dette enzym tillader de vira, der forårsager SARS, MERS, og COVID-19 for at inficere celler og replikere og undertrykke værtens immunfun
- Hvad er forholdet mellem overfladeareal og reaktionshastighed?
- Hvad er tungere 12 pund eller 6 kg?
- NASAs GPM analyserer Atlantic Tropical Storm Ernestos nedbør
- Hvilke organer findes i en rodcelle?
- Hvilken type molekylær bevægelse er det, hvis molekyler mod koncentrationsgradienten fra lav til h…
- Nye designprincipper for spin-baserede kvantematerialer


