Påvirker temperaturen i vandets reaktion?
* Øget kinetisk energi: Højere temperaturer betyder, at vandmolekyler har mere kinetisk energi. De bevæger sig hurtigere og kolliderer med hinanden oftere. Disse kollisioner er vigtige for at bryde obligationer og danne nye, som er kernen i kemiske reaktioner.
* Aktiveringsenergi: Hver kemisk reaktion kræver en vis mængde energi for at komme i gang, kendt som aktiveringsenergien. Varme giver denne energi.
* reaktionshastighed: Når temperaturen stiger, øges hastigheden for de fleste kemiske reaktioner. Dette skyldes, at flere molekyler har nok energi til at overvinde aktiveringsenergibarrieren.
* ligevægt: Ved reversible reaktioner kan temperaturen flytte ligevægtspunktet. Dette betyder, at en højere temperatur kan favorisere dannelsen af produkter i nogle reaktioner, mens den kan favorisere dannelsen af reaktanter i andre.
Eksempler:
* Madlavning: Opvarmning af vand fremskynder madlavningsprocessen. Den højere temperatur hjælper med at nedbryde de kemiske bindinger i mad, hvilket gør det lettere at fordøje.
* opløste: Varmt vand opløser stoffer hurtigere end koldt vand, fordi vandmolekylernes højere kinetiske energi hjælper dem med at bryde opløsningens bindinger.
* enzymaktivitet: Enzymer er biologiske katalysatorer, der fremskynder reaktioner. De har optimale temperaturer, og deres aktivitet falder, hvis temperaturen bliver for høj eller for lav.
Vigtig note: Mens højere temperaturer generelt fremskynder reaktioner, er der nogle undtagelser. I nogle tilfælde kan meget høje temperaturer faktisk bremse eller endda stoppe reaktioner. Dette sker, fordi de høje temperaturer kan skade eller ødelægge de involverede reaktanter eller katalysator.
 Varme artikler
Varme artikler
-
 Strontiumtitanats nye egenskaber er vigtige for elektronikforskningEPR-spektre for de (001)-orienterede enkeltkrystalprøver med form som en stang og en plade af STO:Fe3+ ved T =300 K (a) og af en plade af STO:Mn4+ ved T =150 K (b) . Orienteringerne af prøverne i forh
Strontiumtitanats nye egenskaber er vigtige for elektronikforskningEPR-spektre for de (001)-orienterede enkeltkrystalprøver med form som en stang og en plade af STO:Fe3+ ved T =300 K (a) og af en plade af STO:Mn4+ ved T =150 K (b) . Orienteringerne af prøverne i forh -
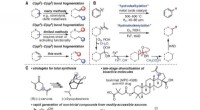 En mere effektiv måde at spalte vedhængende olefiner fra terpener og lignende forbindelserKoncept og anvendelser af hydrodealkenylativ fragmentering af C(sp 3 )–C(sp 2 ) obligationer. (A) Dekonstruktiv fragmentering af C-C-bindinger. (B) Oversigt og foreslået mekanisme for hydrodealken
En mere effektiv måde at spalte vedhængende olefiner fra terpener og lignende forbindelserKoncept og anvendelser af hydrodealkenylativ fragmentering af C(sp 3 )–C(sp 2 ) obligationer. (A) Dekonstruktiv fragmentering af C-C-bindinger. (B) Oversigt og foreslået mekanisme for hydrodealken -
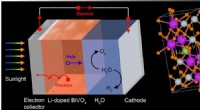 Kørevandsspaltning for at skabe kemiske brændstoffer(Venstre) Under sollys, vismutvanadat (BiVO4) - et lovende elektrodemateriale til vandspaltning - genererer elektron-hul-par (ladningsbærere) for at spalte vand til brint og oxygengas. Ved doping, el
Kørevandsspaltning for at skabe kemiske brændstoffer(Venstre) Under sollys, vismutvanadat (BiVO4) - et lovende elektrodemateriale til vandspaltning - genererer elektron-hul-par (ladningsbærere) for at spalte vand til brint og oxygengas. Ved doping, el -
 Upcycling svampet plastikskum fra sko, madrasser og isoleringPolyurethanskum er notorisk vanskelige at genbruge og ender på lossepladser eller i produkter med lavere værdi, såsom syntetiske tæpper. Kredit:Northwestern University Forskere har udviklet en ny
Upcycling svampet plastikskum fra sko, madrasser og isoleringPolyurethanskum er notorisk vanskelige at genbruge og ender på lossepladser eller i produkter med lavere værdi, såsom syntetiske tæpper. Kredit:Northwestern University Forskere har udviklet en ny
- Hvad er 21,04 N breddegrad og 105,50 E -længdegrad?
- 2-D materialer forbedrer en 3D-verden
- Forskning og politik i et Arktis i forandring
- NASA bekræfter romerske missioners flyvedesign i milepælsgennemgang
- Bevæger solen sig tættere på jorden?
- Undersøgelse viser, hvordan iskolde ydre solsystemsatellitter kan være dannet


