Antallet af atomer barium i 68,2 g fosfat?
1. Bestem den kemiske formel for phosphatforbindelsen:
* Da spørgsmålet beder om antallet af bariumatomer i en fosfatforbindelse, er vi nødt til at kende den specifikke fosfatforbindelse. Almindelige eksempler inkluderer bariumphosphat (BA3 (PO4) 2) og monobariumphosphat (BAHPO4).
2. Beregn den molære masse af phosphatforbindelsen:
* for bariumphosphat (BA3 (PO4) 2):
* BA:137,33 g/mol (x 3) =411,99 g/mol
* P:30,97 g/mol (x 2) =61,94 g/mol
* O:16,00 g/mol (x 8) =128,00 g/mol
* Samlet molmasse:411,99 + 61,94 + 128,00 =601,93 g/mol
* for monobariumphosphat (BAHPO4):
* BA:137,33 g/mol
* H:1,01 g/mol
* P:30,97 g/mol
* O:16,00 g/mol (x 4) =64,00 g/mol
* Samlet molmasse:137,33 + 1,01 + 30,97 + 64,00 =233,31 g/mol
3. Beregn molen af phosphatforbindelsen:
* ved hjælp af bariumphosphat (BA3 (PO4) 2):
* Mol =masse / molmasse =68,2 g / 601,93 g / mol =0,113 mol
* ved hjælp af monobariumphosphat (BAHPO4):
* Mol =masse / molmasse =68,2 g / 233,31 g / mol =0,292 mol
4. Beregn molen af bariumatomer:
* ved hjælp af bariumphosphat (BA3 (PO4) 2):
* Da der er 3 mol barium til hver mol BA3 (PO4) 2, multiplicerer vi molen af Ba3 (PO4) 2 med 3:0,113 mol * 3 =0,339 mol BA
* ved hjælp af monobariumphosphat (BAHPO4):
* Da der er 1 mol barium for hver mol bahpo4, er molen af barium lig med molen af BAHPO4:0,292 mol BA
5. Konverter mol af barium til antallet af atomer:
* ved hjælp af Avogadros nummer (6.022 x 10^23 atomer/mol):
* for bariumphosphat (BA3 (PO4) 2):
* Antal BA -atomer =0,339 mol Ba * 6,022 x 10^23 atomer/mol =2,04 x 10^23 atomer
* for monobariumphosphat (BAHPO4):
* Antal BA -atomer =0,292 mol Ba * 6,022 x 10^23 atomer/mol =1,76 x 10^23 atomer
Derfor afhænger antallet af bariumatomer i 68,2 g fosfat af den specifikke fosfatforbindelse:
* for bariumphosphat (BA3 (PO4) 2): 2,04 x 10^23 bariumatomer
* for monobariumphosphat (BAHPO4): 1,76 x 10^23 bariumatomer
Sidste artikelHvilke salte vil der blive fremstillet af fosforsyre?
Næste artikelHvilke elementer findes som et diatomisk molekyle?
 Varme artikler
Varme artikler
-
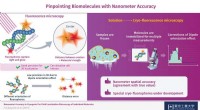 Udpegning af biomolekyler med nanometer nøjagtighedNanometer nøjagtighed i fjernfelts fluorescenslokaliseringsmikroskopi af to fluoroforer bundet til begge ender af 30 basepar af et dobbeltstrenget DNA (dsDNA) molekyle blev demonstreret ved at bruge k
Udpegning af biomolekyler med nanometer nøjagtighedNanometer nøjagtighed i fjernfelts fluorescenslokaliseringsmikroskopi af to fluoroforer bundet til begge ender af 30 basepar af et dobbeltstrenget DNA (dsDNA) molekyle blev demonstreret ved at bruge k -
 Udvikling af en strækbar vibrationsdrevet enhed ved hjælp af en flydende elektretDet nyudviklede flydende elektretmateriale (til venstre) og den bøjelige og strækbare vibrationsdrevne enhed (midten og højre). Kredit:NIST NIMS og AIST udviklede et flydende elektretmateriale, de
Udvikling af en strækbar vibrationsdrevet enhed ved hjælp af en flydende elektretDet nyudviklede flydende elektretmateriale (til venstre) og den bøjelige og strækbare vibrationsdrevne enhed (midten og højre). Kredit:NIST NIMS og AIST udviklede et flydende elektretmateriale, de -
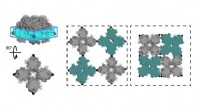 Supercomputer fremkomsten af materiel adfærdKemikere ved University of California, San Diego (UCSD) designet et ark proteiner (C98RhuA), der skifter mellem forskellige porøsitetstilstande og densitet. Cellerne i krystalgitteret er hængslet i hj
Supercomputer fremkomsten af materiel adfærdKemikere ved University of California, San Diego (UCSD) designet et ark proteiner (C98RhuA), der skifter mellem forskellige porøsitetstilstande og densitet. Cellerne i krystalgitteret er hængslet i hj -
 Stimulering af følesansen med kemiBlot ved berøring kan folk skelne mellem overflader kun baseret på mindre kemiske forskelle. Kredit:Charles Dhong Vores øjne kan være vinduer på verden, men vores fingerspidser sætter os i kontakt
Stimulering af følesansen med kemiBlot ved berøring kan folk skelne mellem overflader kun baseret på mindre kemiske forskelle. Kredit:Charles Dhong Vores øjne kan være vinduer på verden, men vores fingerspidser sætter os i kontakt
- Ny metode til at fjerne olie fra vand
- Hvor meget er 930 mm i tommer?
- Jordsundheden øges ved at tilføje små korn og græs til omdriften
- Er det sandt, at videnskab og religion skal være i konfliktforhold til skabelsen af verden?
- Sådan fungerer kontrollerede forbrændinger
- Seks ting at vide om Ingenuity Mars-helikopteren


