Hvor mange elektroner får svovl for at opnå en ædelgaskonfiguration?
Her er hvorfor:
* Svovls elektronkonfiguration: Svovl har 16 elektroner med konfigurationen [NE] 3S² 3P⁴.
* ædle gaskonfiguration: Den nærmeste ædle gas til svovl er argon (AR), der har 18 elektroner med konfigurationen [NE] 3S² 3P⁶.
* At vinde elektroner: For at opnå den stabile, fulde oktet af elektroner som argon, er svovl nødt til at vinde to mere elektroner i sin 3p orbital.
Derfor får svovl to elektroner for at blive en sulfidion (S²⁻) og opnå en ædel gaskonfiguration.
Sidste artikelSukker opløses i te kemisk ejendom eller fysisk ejendom?
Næste artikelHvad er smeltnings- og kogepunkterne på Astatine?
 Varme artikler
Varme artikler
-
 Fremstilling af lysaktiverede proteinerRaziye Karapinar (til venstre) og Stefan Herlitze Kredit:RUB, Kramer En ny strategi til design af lysfølsomme proteiner er blevet udviklet af forskere ved Ruhr-Universität Bochum (RUB). Sådanne pr
Fremstilling af lysaktiverede proteinerRaziye Karapinar (til venstre) og Stefan Herlitze Kredit:RUB, Kramer En ny strategi til design af lysfølsomme proteiner er blevet udviklet af forskere ved Ruhr-Universität Bochum (RUB). Sådanne pr -
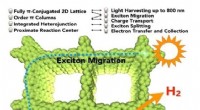 Fotokatalytisk brintproduktion fra vandIllustration af den kulstof-konjugerede kovalente organiske ramme (COF), der viser det fotokatalytiske system, hvor en lang række synligt lys kan høstes til produktion af hydrogengas fra vand. Nanopar
Fotokatalytisk brintproduktion fra vandIllustration af den kulstof-konjugerede kovalente organiske ramme (COF), der viser det fotokatalytiske system, hvor en lang række synligt lys kan høstes til produktion af hydrogengas fra vand. Nanopar -
 Modificeret enzym kan øge anden generations ethanolproduktionVed at bruge et protein produceret af en svamp, der lever i Amazonas, Brasilianske forskere udviklede et molekyle, der er i stand til at øge glukosefrigivelsen fra biomasse til fermentering (sukkerrør
Modificeret enzym kan øge anden generations ethanolproduktionVed at bruge et protein produceret af en svamp, der lever i Amazonas, Brasilianske forskere udviklede et molekyle, der er i stand til at øge glukosefrigivelsen fra biomasse til fermentering (sukkerrør -
 Forskere registrerer greenlight gasdetektering ved stuetemperaturSkyder. Kredit:MIPT Russiske forskere har udviklet en mekanisme til at detektere molekylært brint ved hjælp af grønt lys til at belyse en nanokrystallinsk sammensat sensor baseret på zink og indiu
Forskere registrerer greenlight gasdetektering ved stuetemperaturSkyder. Kredit:MIPT Russiske forskere har udviklet en mekanisme til at detektere molekylært brint ved hjælp af grønt lys til at belyse en nanokrystallinsk sammensat sensor baseret på zink og indiu
- Forsker dokumenterer nøjagtige placeringer, gange af Ansel Adams Alaska billeder
- Undersøgelse rejser spørgsmålet:Hvorfor er forstenede hår så sjældne?
- Hvilken type arv, når genotypen hverken er homozygot eller heterozygot?
- Hvordan bliver stjerner useriøse?
- Jorden svulmede til 3. varmeste august, sommer på rekord
- Hvad er atomet, hvis massen er 2,67x10-24 g?


