Opløses fast gas eller flydende opløst stof bedst under høje temperaturforhold?
Her er hvorfor:
* Øget kinetisk energi: Når temperaturen stiger, får molekylerne af både opløsningsmiddel og opløsningsmiddel kinetisk energi. Dette betyder, at de bevæger sig hurtigere og kolliderer oftere.
* Breaking intermolekylære kræfter: Den øgede kinetiske energi hjælper med at overvinde de intermolekylære kræfter, der holder de opløste partikler sammen, så de kan gå i stykker og opløses.
* Forbedret solvation: Højere temperaturer øger også opløsningsmidlets evne til at solvere (surround) opløsningspartiklerne, hvilket yderligere hjælper opløsningsprocessen.
Undtagelser:
* Gasser: Gasser opløses * mindre * godt ved højere temperaturer. Dette skyldes, at den øgede kinetiske energi gør det muligt for gasmolekylerne lettere at flygte fra opløsningen.
* væsker: Effekten af temperatur på flydende opløst opløselighed er mindre forudsigelig og afhænger af den specifikke væske. Nogle væsker bliver mere opløselige med stigende temperatur, mens andre bliver mindre opløselige.
Kortfattet:
* faste stoffer: Generelt mere opløselig ved højere temperaturer.
* Gasser: Generelt mindre opløselig ved højere temperaturer.
* væsker: Variabel afhængig af den specifikke væske.
 Varme artikler
Varme artikler
-
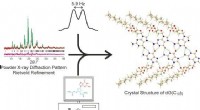 Ny eksperimentel strategi belyser kompleks krystalstrukturForskere ved universiteterne i Warwick og Cardiff har brugt en kombineret pulver XRD, solid-state NMR og beregningsmetode til at bestemme strukturen af 3, 5-bis-O-decanoyl-2-deoxyguanosin. En kombi
Ny eksperimentel strategi belyser kompleks krystalstrukturForskere ved universiteterne i Warwick og Cardiff har brugt en kombineret pulver XRD, solid-state NMR og beregningsmetode til at bestemme strukturen af 3, 5-bis-O-decanoyl-2-deoxyguanosin. En kombi -
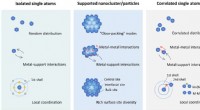 Nye elektrokatalysatorer varsler kulstofneutralitetC-SACer med metal-metal interaktioner. Sammenligning af C-SACer med de konventionelle isolerede SACer og understøttede metalliske klynge/nanopartikelkatalysatorer fra perspektivet af rumlig fordeling,
Nye elektrokatalysatorer varsler kulstofneutralitetC-SACer med metal-metal interaktioner. Sammenligning af C-SACer med de konventionelle isolerede SACer og understøttede metalliske klynge/nanopartikelkatalysatorer fra perspektivet af rumlig fordeling, -
 Forskere afslører dynamikken mellem klynger og klynger mellem thiolatbeskyttede guld-sølvlegeringe…Kredit:CC0 Public Domain Fra effektiv medicin til molekylære sensorer til brændselsceller, metalklynger bliver grundlæggende nyttige i sundheden, miljø, og energisektorer. Denne forskelligartede f
Forskere afslører dynamikken mellem klynger og klynger mellem thiolatbeskyttede guld-sølvlegeringe…Kredit:CC0 Public Domain Fra effektiv medicin til molekylære sensorer til brændselsceller, metalklynger bliver grundlæggende nyttige i sundheden, miljø, og energisektorer. Denne forskelligartede f -
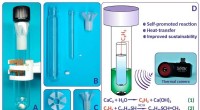 Kemikere opfinder et effektivt termisk kamera for at reducere omkostningerne til kemisk forskningReaktionsopsætningen ved hjælp af den udviklede rør-i-rør-reaktor:(A)—reaktoren klar til brug; (B)—den adskilte reaktor; (C)-nylonforing; (D)—termisk kamera og skemaet for rør-i-rør-reaktor og to trin
Kemikere opfinder et effektivt termisk kamera for at reducere omkostningerne til kemisk forskningReaktionsopsætningen ved hjælp af den udviklede rør-i-rør-reaktor:(A)—reaktoren klar til brug; (B)—den adskilte reaktor; (C)-nylonforing; (D)—termisk kamera og skemaet for rør-i-rør-reaktor og to trin
- Hvordan hjælper træer os?
- Hvordan virker en EMF-detektor?
- Verdens luftfartsselskaber forpligter sig til netto nul CO2-emissioner inden 2050
- Hvad er magnetiske striber på havbunden?
- FAST er lovende i interplanetarisk scintillationsobservation
- Hvorfor tror forskere, at nogle uddøde kæmpe flyvende krybdyr tog sig af deres unger


