Hvilken kemisk egenskab er til stede i stoffer, der reagerer langsomt?
Faktorer, der påvirker reaktionshastigheden:
* Aktiveringsenergi: Dette er den mindste mængde energimolekyler, der er nødt til at kollidere med hinanden effektivt og starte en reaktion. Stoffer med høje aktiveringsenergier reagerer langsomt, fordi færre molekyler har nok energi til at overvinde denne barriere.
* Koncentration: Højere koncentrationer af reaktanter betyder, at der forekommer flere kollisioner, hvilket øger chancerne for vellykkede reaktioner.
* Temperatur: Højere temperaturer giver molekyler mere kinetisk energi, hvilket fører til hyppigere og kraftige kollisioner, hvilket øger reaktionshastigheden.
* overfladeareal: For reaktioner, der involverer faste stoffer, giver et større overfladeareal flere kontaktpunkter med reaktanter, hvilket øger reaktionshastigheden.
* katalysator: Katalysatorer fremskynder reaktioner ved at tilvejebringe en alternativ vej med lavere aktiveringsenergi.
* Natur af reaktanter: Reaktanters kemiske struktur og bindingsstyrke påvirker, hvor let de bryder og danner nye bindinger.
Det er vigtigt at huske:
* "Langsom" er relativ. Det, der betragtes som langsomt i en sammenhæng, kan være hurtigt i en anden.
* Kemiske egenskaber hos reaktanter, såsom deres reaktivitet, bindingsstyrke og polariserbarhed, bidrager til den samlede reaktionshastighed.
Eksempel:
Jernrustning (oxidation) er en langsom reaktion på grund af den krævede høje aktiveringsenergi. Men hvis vi øger overfladearealet af jern (f.eks. Ved hjælp af jernuld) eller indfører en katalysator som salt, vil reaktionshastigheden stige, hvilket gør rusten processen hurtigere.
I stedet for at fokusere på en enkelt egenskab, skal du overveje samspillet mellem forskellige faktorer for at forstå, hvorfor et stof reagerer langsomt.
Sidste artikelHvad hopper molekyler rundt i?
Næste artikelHvorfor er atomet for technetium elektrisk neutral?
 Varme artikler
Varme artikler
-
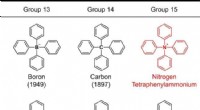 Syntese af tetraphenylammonium:Bekræftelse af eksistensen af fantomionenFigur 1. Strukturer af tetraphenyl-substituerede grundstoffer, der tilhører grupperne 13-15. Tallet i parentes angiver synteseåret. Kredit:Kanazawa University Tetraphenylammonium, med alle fire hyd
Syntese af tetraphenylammonium:Bekræftelse af eksistensen af fantomionenFigur 1. Strukturer af tetraphenyl-substituerede grundstoffer, der tilhører grupperne 13-15. Tallet i parentes angiver synteseåret. Kredit:Kanazawa University Tetraphenylammonium, med alle fire hyd -
 Kampen mod huller i tænderne får hjælp til et nyt smart materialeProfessor Ben Hatton ved University of Toronto, Professor Yoav Finer og ph.d.-kandidat Cameron Stewart. Kredit:Yodit Tedla/Tandlægefakultetet. Når patienter går til tandlægen for at fylde et hulru
Kampen mod huller i tænderne får hjælp til et nyt smart materialeProfessor Ben Hatton ved University of Toronto, Professor Yoav Finer og ph.d.-kandidat Cameron Stewart. Kredit:Yodit Tedla/Tandlægefakultetet. Når patienter går til tandlægen for at fylde et hulru -
 Biomateriale kunne holde tænderne i live efter rodbehandlingKredit:CC0 Public Domain En rodbehandling står højt på de flestes liste over frygtede tandbehandlinger. Selvom den lange og til tider smertefulde operation lindrer smerten ved en infektion, en rod
Biomateriale kunne holde tænderne i live efter rodbehandlingKredit:CC0 Public Domain En rodbehandling står højt på de flestes liste over frygtede tandbehandlinger. Selvom den lange og til tider smertefulde operation lindrer smerten ved en infektion, en rod -
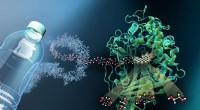 Forskere karakteriserer molekylær sakse til plastaffaldBilledet viser strukturen af MHETase bundet til en ikke-hydrolyserbar PET-afledt ligand (MHETA). Symbolske polymerfibre forbinder MHETA med en typisk PET-flaske, hvilket indikerer det store potentia
Forskere karakteriserer molekylær sakse til plastaffaldBilledet viser strukturen af MHETase bundet til en ikke-hydrolyserbar PET-afledt ligand (MHETA). Symbolske polymerfibre forbinder MHETA med en typisk PET-flaske, hvilket indikerer det store potentia
- Denne mand blev fyret af en computer - ægte kunstig intelligens kunne have reddet ham
- Google er stadig under beskydning på grund af EU's antitrust-overtrædelser
- Udforskning af mikrostrukturer for højtydende materialer
- Apple kan forsøde macOS 10.15 med understøttelse af ekstern iPad-skærm
- Første bevis opdaget af en gigantisk rest omkring en eksploderende stjerne
- Funktionerne af en organismers dele er relateret til disse dele?


