Hvad er inerte og labile ligander?
inerte og labile ligander:en hurtig sammenbrud
inerte ligander danner stærke bindinger med den centrale metalion, hvilket gør dem modstandsdygtige over for substitutionsreaktioner. De forbliver fastgjort selv i nærvær af andre potentielle ligander.
Labile ligander Form svage bindinger med den centrale metalion, hvilket gør dem let erstattet af andre ligander. De er modtagelige for substitutionsreaktioner, selv i nærvær af svage nukleofiler.
Her er en mere detaljeret forklaring:
inerte ligander:
* Stærke M-L-obligationer: Disse ligander danner stærke koordinatbindinger med metalionen, ofte på grund af:
* Høj opladningstæthed på liganden: Meget ladede ligander som CN- og NH3 danner stærkere bindinger.
* LIGHT STØRRELSE AF LIGAND: Mindre ligander kan komme tættere på metalionen, hvilket fører til stærkere attraktioner.
* tilstedeværelse af π-backbonding: Dette involverer donation af elektroner fra metal-d-orbitaler til tomme orbitaler på liganden, hvilket yderligere styrker bindingen.
* Slow Ligand Exchange: Den stærke binding gør det vanskeligt for andre ligander at fortrænge dem. Dette betyder, at de langsomme substitutionsreaktioner er langsomme.
Labile ligander:
* svage M-L-obligationer: Disse ligander danner relativt svage koordinatbindinger med metalionen, ofte på grund af:
* Lav opladningstæthed på liganden: Svagt ladede ligander som H2O og CL-form svagere obligationer.
* Stor størrelse på liganden: Større ligander er længere væk fra metalionen, hvilket fører til svagere interaktioner.
* fravær af π-backbonding: Ingen ekstra stabilisering fra elektrondonation til ligand -orbitaler.
* hurtig ligandudveksling: Den svage binding gør det nemt for andre ligander at fortrænge dem. Dette oversættes til hurtige substitutionsreaktioner.
Vigtige punkter:
* Inerthed og labilitet er kinetiske udtryk: De beskriver * hastighed * for ligandsubstitution, ikke den termodynamiske stabilitet af komplekset. Et termodynamisk stabilt kompleks kan stadig være labilt, hvis dens ligandudveksling er hurtig.
* Faktorer, der påvirker inertitet/labilitet:
* Metalionens art: Overgangsmetaller med højere ladninger og mindre ioniske radier har en tendens til at danne flere inerte komplekser.
* Liganders natur: Ligander med høj opladningstæthed og lille størrelse er mere tilbøjelige til at være inerte.
* opløsningsmiddel: Polære opløsningsmidler kan stabilisere overgangstilstanden, hvilket gør substitutionsreaktioner hurtigere.
Eksempler:
* inert: Komplekser med CN-, NH3 og CO-ligander er typisk inerte.
* labil: Komplekser med H2O, CL- og BR-ligander er typisk labile.
Ansøgninger:
At forstå begreberne inerte og labile ligander er afgørende inden for forskellige områder:
* Koordinationskemi: Forudsigelse af stabiliteten og reaktiviteten af koordinationskomplekser.
* katalyse: Design af katalysatorer med specifikke ligandmiljøer til fremme af visse reaktioner.
* Biokemi: Forklaring af opførelsen af metalioner i biologiske systemer.
Fortæl mig, hvis du har yderligere spørgsmål om disse koncepter.
 Varme artikler
Varme artikler
-
 Vinder af årets sidste videnskabelige Nobelpris, der skal udnævnesKredit:Wikipedia Nobelprisen i kemi, som hædrer forskere for fremskridt i at studere, hvordan molekyler kombineres og interagerer, offentliggøres onsdag af Det Kongelige Svenske Videnskabsakademi.
Vinder af årets sidste videnskabelige Nobelpris, der skal udnævnesKredit:Wikipedia Nobelprisen i kemi, som hædrer forskere for fremskridt i at studere, hvordan molekyler kombineres og interagerer, offentliggøres onsdag af Det Kongelige Svenske Videnskabsakademi. -
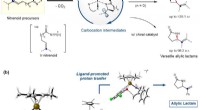 Ny katalytisk tilgang til adgang til nøglemellemkarbokation98%). (b) Beregningsmodellering til at bevise mellemvirkningen af carbocation og for at forstå det selektivitetsbestemmende trin. Kredit:IBS Den menneskelige civilisation i det 21. århundrede er
Ny katalytisk tilgang til adgang til nøglemellemkarbokation98%). (b) Beregningsmodellering til at bevise mellemvirkningen af carbocation og for at forstå det selektivitetsbestemmende trin. Kredit:IBS Den menneskelige civilisation i det 21. århundrede er -
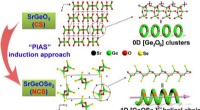 Ny delvis isovalent anionsubstitutionsinduktionsstrategi til design af infrarøde, ikke -lineære op…Strukturel transformation fra CS -forbindelse SrGeO3 til NCS SrGeOSe2. Kredit:Prof. ZHU’s Group Infrarøde ikke -lineære optiske (IR – NLO) materialer er afgørende for en bred vifte af applikatione
Ny delvis isovalent anionsubstitutionsinduktionsstrategi til design af infrarøde, ikke -lineære op…Strukturel transformation fra CS -forbindelse SrGeO3 til NCS SrGeOSe2. Kredit:Prof. ZHU’s Group Infrarøde ikke -lineære optiske (IR – NLO) materialer er afgørende for en bred vifte af applikatione -
 Omvendt brændselscelle omdanner affaldskulstof til værdifulde produkter med rekordhastighederVenstre mod højre:Adnan Ozden, Joshua Wicks, og F. Pelayo García de Arquer er blandt teammedlemmerne, der har designet en elektrolysator, der omdanner CO 2 til værdifulde produkter 10 gange hurtiger
Omvendt brændselscelle omdanner affaldskulstof til værdifulde produkter med rekordhastighederVenstre mod højre:Adnan Ozden, Joshua Wicks, og F. Pelayo García de Arquer er blandt teammedlemmerne, der har designet en elektrolysator, der omdanner CO 2 til værdifulde produkter 10 gange hurtiger
- Strukturen af en komet anses for at være som stor eller massefrossen is og sten?
- Hvad er den mindste arvenhed?
- Hvilke typer energi bruger en satellit?
- Hvor tyk er 0,118 inches?
- Hvad synes videnskabsmænd førte til den enorme variation set i blomster?
- Er du sikker på lyn, hvis stormen endnu ikke har ramt?


