Hvad er et stof dannet af en elektrostatisk tiltrækning mellem atomer eller grupper af modsat ladning?
Her er en sammenbrud:
* Elektrostatisk attraktion: Dette henviser til kraften af tiltrækning mellem modsatte afgifter.
* atomer eller grupper af modsat ladning: I ioniske forbindelser mister et atom (eller gruppe af atomer) elektroner og bliver positivt ladet (kation), mens et andet atom (eller gruppe af atomer) får elektroner og bliver negativt ladet (anion). Disse modsatte anklager tiltrækker hinanden.
Nøgleegenskaber for ioniske forbindelser:
* høje smelte- og kogepunkter: På grund af de stærke elektrostatiske kræfter, der holder dem sammen.
* fast ved stuetemperatur: Igen på grund af de stærke kræfter.
* Led elektricitet, når den opløses i vand eller smeltet: Ionerne er frie til at bevæge sig og bære en elektrisk strøm.
* danner ofte krystalgitter: Det regelmæssige arrangement af ioner maksimerer den elektrostatiske tiltrækning.
Eksempler på ioniske forbindelser:
* natriumchlorid (NaCl): Tabel salt, dannet af tiltrækningen af natriumkationer (Na+) og chloridanioner (Cl-).
* calciumcarbonat (CACO3): Fundet i kalksten og muslingeskaller, dannet af calciumkationer (Ca2+) og carbonatanioner (CO32-).
* magnesiumoxid (MGO): Anvendt i isolering og cement, dannet af magnesiumkationer (MG2+) og oxidanioner (O2-).
Fortæl mig, hvis du gerne vil vide mere om ionisk binding eller ioniske forbindelser!
Sidste artikelHvad kaldes de fire orbitaler i et atom?
Næste artikelHvordan bruges kulbrinter?
 Varme artikler
Varme artikler
-
 Ikke alle naturens lagdelte strukturer er hårde som dyreskaller og gevirer, undersøgelse finderAnkerpiggene, der holder svampearten Euplectella aspergillum til havbunden, har en indviklet lagdelt indre struktur. Lignende lagdelte strukturer er kendt for at øge sejheden af materialer som knogl
Ikke alle naturens lagdelte strukturer er hårde som dyreskaller og gevirer, undersøgelse finderAnkerpiggene, der holder svampearten Euplectella aspergillum til havbunden, har en indviklet lagdelt indre struktur. Lignende lagdelte strukturer er kendt for at øge sejheden af materialer som knogl -
 Den nuværende model til opbevaring af atomaffald er ufuldstændigKredit:CC0 Public Domain De materialer, USA og andre lande planlægger at bruge til at opbevare atomaffald på højt niveau, vil sandsynligvis nedbrydes hurtigere end nogen tidligere kendte på grund
Den nuværende model til opbevaring af atomaffald er ufuldstændigKredit:CC0 Public Domain De materialer, USA og andre lande planlægger at bruge til at opbevare atomaffald på højt niveau, vil sandsynligvis nedbrydes hurtigere end nogen tidligere kendte på grund -
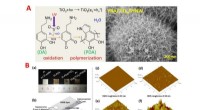 Nyt foreslået strategi tilbyder smart fleksibel neural elektrode med høj effektivitetA. (a) Skematisk diagram af accelereret PDA-polymerisation med nano-TiO 2 og UV, (b) SEM for PDA/TiO 2 /PtNW modificeret elektrode. B. (a) Prøver af forskellige coatede elektroder (1 cm × 1 cm). (
Nyt foreslået strategi tilbyder smart fleksibel neural elektrode med høj effektivitetA. (a) Skematisk diagram af accelereret PDA-polymerisation med nano-TiO 2 og UV, (b) SEM for PDA/TiO 2 /PtNW modificeret elektrode. B. (a) Prøver af forskellige coatede elektroder (1 cm × 1 cm). ( -
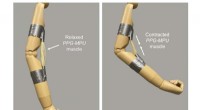 Højenergi formhukommelsespolymer kunne en dag hjælpe robotter med at bøje deres musklerEn kunstig muskel lavet af en strakt formhukommelsespolymer trækker sig sammen ved opvarmning, bøjer en mannequin arm. Kredit:Tilpasset fra ACS Central Science 2021, DOI:10.1021/acscentsci.1c00829
Højenergi formhukommelsespolymer kunne en dag hjælpe robotter med at bøje deres musklerEn kunstig muskel lavet af en strakt formhukommelsespolymer trækker sig sammen ved opvarmning, bøjer en mannequin arm. Kredit:Tilpasset fra ACS Central Science 2021, DOI:10.1021/acscentsci.1c00829


