Hvad er den halve reaktion af Ba ZnsO4-Baso4 Zn?
1. Identificer oxidation og reduktion:
* Oxidation: Zink (Zn) mister elektroner, og dens oxidationstilstand stiger fra 0 til +2.
* reduktion: Barium (BA) får elektroner, og dens oxidationstilstand falder fra +2 til 0.
2. Skriv halvreaktionerne:
* Oxidation Halvreaktion:
Zn (S) → Zn²⁺ (aq) + 2e⁻
* reduktion halvreaktion:
Ba²⁺ (aq) + 2e⁻ → BA (s)
Forklaring:
* Zn (s) → Zn²⁺ (aq) + 2e⁻: Zink i sin solide tilstand (Zn (S)) mister to elektroner for at blive en zinkion (Zn²⁺) i opløsning.
* ba²⁺ (aq) + 2e⁻ → ba (s): Bariumion i opløsning (Ba²⁺) får to elektroner til at blive fast bariummetal (BA (S)).
Vigtig note: Sulfationen (so₄²⁻) er en tilskuerion i denne reaktion. Det deltager ikke i elektronoverførslen og er ikke inkluderet i halvreaktionerne.
Sidste artikelHvor kan metalloider findes på den periodiske tabel?
Næste artikelHvilke stoffer er uopløselige?
 Varme artikler
Varme artikler
-
 Forskere udvikler smartphone-baseret ægløsningstestKredit: Lab on a Chip (2018). DOI:10.1039/C8LC00792F Efterforskere fra Brigham and Womens Hospital er ved at udvikle en automatiseret, lavprisværktøj til at forudsige en kvindes ægløsning og hjæl
Forskere udvikler smartphone-baseret ægløsningstestKredit: Lab on a Chip (2018). DOI:10.1039/C8LC00792F Efterforskere fra Brigham and Womens Hospital er ved at udvikle en automatiseret, lavprisværktøj til at forudsige en kvindes ægløsning og hjæl -
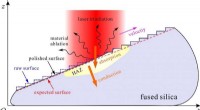 CO2 -laserablation fører en ny vej til skræddersyede kontinuerlige smeltede silicaoverfladerFigur 1. Skematisk diagram for 2-D numerisk model af CO 2 laserablation. Kredit:SIOM Smeltet silica er et vigtigt materiale til mange anvendelser inden for optik og fotonik på grund af dets frem
CO2 -laserablation fører en ny vej til skræddersyede kontinuerlige smeltede silicaoverfladerFigur 1. Skematisk diagram for 2-D numerisk model af CO 2 laserablation. Kredit:SIOM Smeltet silica er et vigtigt materiale til mange anvendelser inden for optik og fotonik på grund af dets frem -
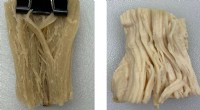 Menneskelige celler optager mindre protein fra plantebaseret kød end fra kyllingEn køderstatning (til venstre) ligner kyllingekød (til højre), men dens proteiner absorberes ikke så godt af menneskeceller. Kredit:Bearbejdet fra Journal of Agricultural and Food Chemistry 2022, DOI:
Menneskelige celler optager mindre protein fra plantebaseret kød end fra kyllingEn køderstatning (til venstre) ligner kyllingekød (til højre), men dens proteiner absorberes ikke så godt af menneskeceller. Kredit:Bearbejdet fra Journal of Agricultural and Food Chemistry 2022, DOI: -
 Bøjning af DNA koster mindre energi end antagetKredit:Leiden Institut for Fysik Måden DNA folder i høj grad bestemmer, hvilke gener der udlæses. John van Noort og hans gruppe har kvantificeret, hvor let sammenrullede DNA-dele stables. Dette ko
Bøjning af DNA koster mindre energi end antagetKredit:Leiden Institut for Fysik Måden DNA folder i høj grad bestemmer, hvilke gener der udlæses. John van Noort og hans gruppe har kvantificeret, hvor let sammenrullede DNA-dele stables. Dette ko
- Hvad er de tre midler til mekanisk forvitring?
- Hvad er kalksten i cementkvalitet?
- Hvad forårsager farveændringen og nedbøren i vand?
- Hvorfor er solen en sekundær stjerne?
- Hvordan er dyr og planter tilpasset, hvor de bor?
- Hvad er forskellen i udseende mellem stødende klipper, der er afkølet langsomt og hurtigt?


