Hvilke stoffer er uopløselige?
Generelle principper for opløselighed:
* "som opløser som": Polære opløsningsmidler (som vand) opløser polære opløste stoffer (som sukker), mens ikke -polære opløsningsmidler (som olie) opløser ikke -polære opløste stoffer (som fedt).
* opløselighed påvirkes af temperatur: Generelt øger stigende temperaturopløselighed.
* opløselighed påvirkes af pres: For gasser øger stigende trykopløselighed.
Eksempler på stoffer, der ofte betragtes som uopløselige:
* i vand:
* Mange salte: For eksempel er sølvchlorid (AGCL) uopløseligt i vand.
* Mange metaloxider: For eksempel er jernoxid (Fe2O3) uopløseligt i vand.
* mange metalhydroxider: F.eks. Er aluminiumshydroxid (AL (OH) 3) uopløselig i vand.
* ikke -polære molekyler: For eksempel er olier og fedt uopløselige i vand.
* i andre opløsningsmidler: Opløselighed afhænger af det anvendte specifikke opløsningsmiddel. For eksempel er mange stoffer, der er uopløselige i vand, opløselige i organiske opløsningsmidler som ethanol eller acetone.
Vigtige punkter:
* "Uopløselig" er ikke absolut: Selv stoffer, der betragtes som uopløselige, vil til en vis grad opløses i et givet opløsningsmiddel.
* opløselighed er en dynamisk proces: Uopløselige stoffer har stadig molekyler, der interagerer med opløsningsmidlet, bare ikke i omfanget af dannelse af en opløsning.
* Der er undtagelser: Nogle forbindelser, der typisk betragtes som uopløselige, kan opløses under specifikke betingelser (f.eks. Høj temperatur, tilstedeværelse af et andet opløsningsmiddel).
For at finde specifikke opløselighedsoplysninger skal du konsultere pålidelige kilder som kemihåndbøger, databaser eller forskningsartikler.
Sidste artikelHvad er den halve reaktion af Ba ZnsO4-Baso4 Zn?
Næste artikelHvad er produkterne fra C6H12O6 plus O2?
 Varme artikler
Varme artikler
-
 Plastfilm beskytter overflader mod ny coronavirus ved kontaktLaboratorietests viste, at film indeholdende sølv-silica nanopartikler var i stand til at fjerne 99,84% af SARS-CoV-2 partikler efter eksponering i to minutter. Kredit:Promaflex En klæbende plastf
Plastfilm beskytter overflader mod ny coronavirus ved kontaktLaboratorietests viste, at film indeholdende sølv-silica nanopartikler var i stand til at fjerne 99,84% af SARS-CoV-2 partikler efter eksponering i to minutter. Kredit:Promaflex En klæbende plastf -
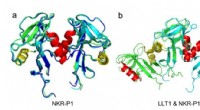 Fra atomet til naturlig dræbercelle:Historien om en uventet proteinstrukturStruktur af human NKR-P1, der viser den unikke dimeriseringsgrænseflade. Panel (a) sammenligner krystalstrukturer af NKR-P1-receptorbindende domæne-dimerer. Panel (b) viser en strukturel sammenligning
Fra atomet til naturlig dræbercelle:Historien om en uventet proteinstrukturStruktur af human NKR-P1, der viser den unikke dimeriseringsgrænseflade. Panel (a) sammenligner krystalstrukturer af NKR-P1-receptorbindende domæne-dimerer. Panel (b) viser en strukturel sammenligning -
 Søpindsvinsrygge kunne fikse knoglerForskere har udviklet et knogletransplantationsmateriale lavet af søpindsvinsrygge. Kredit:American Chemical Society Mere end 2 millioner procedurer hvert år finder sted rundt om i verden for at h
Søpindsvinsrygge kunne fikse knoglerForskere har udviklet et knogletransplantationsmateriale lavet af søpindsvinsrygge. Kredit:American Chemical Society Mere end 2 millioner procedurer hvert år finder sted rundt om i verden for at h -
 Brug af bakterier fra varme kilder, biokemiker studerer RNA-splejsning hos menneskerAaron Robart, Assisterende professor, WVU School of Medicine, Institut for Biokemi. Kredit:Aira Burkhart/West Virginia University Omkring 70 procent af det menneskelige genom koder ikke for noget.
Brug af bakterier fra varme kilder, biokemiker studerer RNA-splejsning hos menneskerAaron Robart, Assisterende professor, WVU School of Medicine, Institut for Biokemi. Kredit:Aira Burkhart/West Virginia University Omkring 70 procent af det menneskelige genom koder ikke for noget.
- Hvem var den første til at anerkende miljøets rolle som en betydelig faktor i evolutionær ændrin…
- Hvilken krop af vand grænser op til det karolingiske imperium til Notheast?
- Ultrasensitiv biosensor kan detektere proteiner, hjælp til kræftdiagnose
- Antallet af børnefattigdom kan halveres i det næste årti efter forslag i en ny ekspertrapport
- Undersøgelse viser, hvordan kvindelige immunceller holder deres andet X-kromosom lukket
- Hvordan virksomheder udformer træningsprogrammer for koncertmedarbejdere, kan øge forfremmelse og …


