Brug af bakterier fra varme kilder, biokemiker studerer RNA-splejsning hos mennesker

Aaron Robart, Assisterende professor, WVU School of Medicine, Institut for Biokemi. Kredit:Aira Burkhart/West Virginia University
Omkring 70 procent af det menneskelige genom koder ikke for noget. Når det er transskriberet til RNA - de instruktioner, vores celler følger, når de laver proteiner - indeholder det meste af meddelelsen ingen brugbar information. Som forsker Aaron Robart fra West Virginia University udtrykte det, det er "junk-DNA".
Robart studerer, hvordan celler katalyserer fjernelsen af dette ikke-kodende skrammel for at forstå det RNA, der er tilbage. At gøre det, han vil bruge bakterier, der trives i varme kilder. National Institutes of Health har tildelt ham 1,6 millioner dollars til det femårige projekt.
Hans resultater kan uddybe, hvad vi ved om lidelser forbundet med ændringer i genekspression - såsom diabetes og kræft - og afsløre mere om det menneskelige genoms udvikling.
At lære vores bakterielle forfædre at kende
"Man tror, at livet på jorden opstod med katalytisk RNA, " sagde Robart, en adjunkt i biokemi på School of Medicine. "Før der var proteiner, før der var DNA, før der var celler, RNA blev foldet op til kompleks, tredimensionelle strukturer og finde ud af livets kemi."
Denne primitive proces ligger stadig til grund for, hvordan celler bringer orden til kodende og ikke-kodende RNA i dag, om disse celler er en del af et menneske, en hyæne, en hortensia eller en Helicobacter-bakterie. Ved at undersøge, hvordan simple organismer udfører denne opgave, videnskabsmænd som Robart kan ekstrapolere deres resultater og bedre forstå, hvordan mere komplekse livsformer – inklusive os – gør det, også.
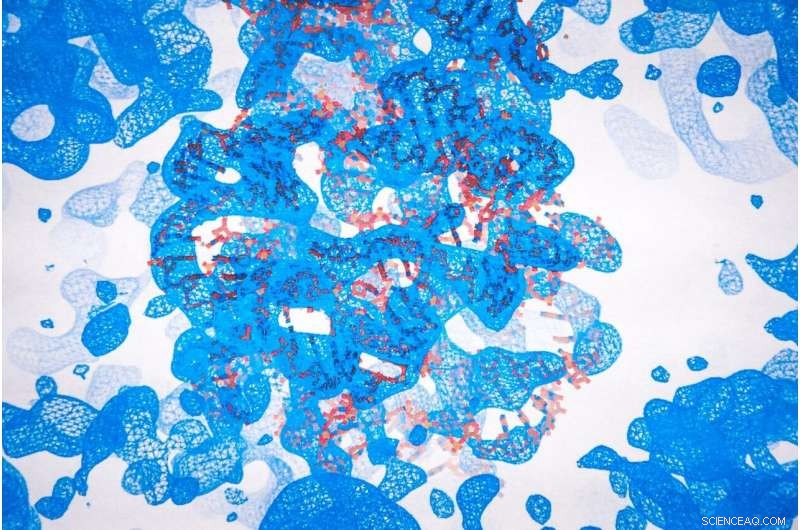
Ved at kortlægge krystalstrukturer som denne, forskere kan bedre forstå de biokemiske processer, der gør livet muligt. Aaron Robart, en adjunkt i School of Medicine's Biochemistry Department, er blevet tildelt 1,6 millioner dollars fra National Institutes of Health til at studere den biokemi og krystallografi, der ligger til grund for RNA-splejsning. RNA er den arbejdsplan, som celler følger, når de udfører instruktionerne kodet i DNA. Splejsning af RNA danner sammenhængende instruktioner til proteinsyntese, men det kan også føre til skadelige ændringer i genekspression. Kredit:Aira Burkhart/West Virginia University
"Inde i dine celler, DNA er din hovedkopi. Det er transskriberet til en fungerende plan af RNA, og så bruges RNA som instruktioner til at lave proteiner. Det eneste problem er, instruktionerne er noget krypterede. Exoner er bits af RNA, der læses som instruktioner til fremstilling af proteiner. Imidlertid, de bliver ofte afbrudt af ikke-kodende introner, " sagde Robart.
Han sammenligner processen med en kat, der går hen over dit tastatur, mens du skriver noget. De ord, du har skrevet, er exoner; det nonsens din kat "typer" er introner.
Før dine celler overhovedet kan prøve at gøre, hvad RNA fortæller dem, de skal fjerne disse introner og bringe exonerne sammen for at danne et sammenhængende sæt instruktioner. En kompliceret molekylær maskine kaldet spliceosomet udfører denne opgave, som – hos mennesker – involverer mange forskellige RNA'er og hundredvis af proteiner.
Bakteriers primitive katalytiske introner fungerer på samme måde som vores eget splejsningsmaskineri, omend på en mindre kompliceret måde. De er forfædre til splejsosomerne, der arbejder i vores egne celler. "Du ser deres fingeraftryk overalt i de essentielle maskiner, der driver vores cellulære funktioner. Vi bruger disse molekylære fossiler til at give os indsigt i den katalytiske kerne, der driver disse maskiner, " sagde Robart.
En usandsynlig proxy for menneskelige celler:varmekildebakterier
Robart vil bruge en art af eksotiske, varmeelskende bakterier som model. Arten er fordelagtig, fordi den producerer meget aktive og stabile enzymer, der splejser og rekonfigurerer RNA.
"Vi brugte omkring halvandet år på at teste snesevis af forskellige eksempler for at finde nogle få arter, der havde proteiner, der kunne ændres til oprensning fra overekspressionssystemer ved høje niveauer, fordi vi har brug for en masse protein for at prøve at lave krystallisation, " sagde han. "Vi har afsløret et af de mest aktive enzymer i denne klasse, fra en termofil bakterie, der trives i varme kilder."
Efter at have dyrket og isoleret proteiner og RNA i store volumener, han og hans team vil analysere de biokemiske processer, der forekommer inde i celler, når introner splejses, frigivet og adskilt. De vil også fjernstyre Argonne National Laboratory's Advanced Photon Source - som vil udsætte de krystalliserede molekyler for ultra-lyse, højenergi røntgenstråler - for at fange øjebliksbilleder af processens kemi i aktion og lære om de molekylære mekanismer bag den.
Ikke alene vil Robart og hans team få indsigt i, hvordan spliceosomet udskærer ikke-kodende RNA, men de vil også skelne, hvordan junk-DNA'et forplantes ved at indsætte det andre steder i genomet. Det er som om, i stedet for at slette den gobbledygook, som din kat har indsat i dit dokument, du kopierer og indsætter det i et helt andet afsnit.
Denne proces - kaldet retrotransposition - kan ligge til grund for forskellige forhold, der udspringer af genetiske mutationer. "Det er en drivende funktion af genomudviklingen og også af sygdom, " sagde Robart. "Spontane mutationer opstår fra disse processer, der er i gang i os hele tiden."
Selvom hans projekt ikke omhandler nogen enkelt sygdom eller behandling, det, han afslører, kan lægge grundlaget for at udvikle RNA-baserede terapier, der sigter mod at kontrollere de underliggende ændringer i genekspression, der findes i mange sygdomme.
"Vi forsøger at forstå det grundlæggende, " sagde Robart. "Du kan ikke prøve at ordne noget, før du forstår, hvordan det virker."
 Varme artikler
Varme artikler
-
 Samtidig emission af ortogonal handedness i cirkulær polariseringen, skematiske diagrammer af fremstillingsprocessen af den cirkulære polarisations-emitterende enhed (dvs. den 1. gnidning af AL22636 belagt på CuPc. ii, spin coating og tørring af F8BT lag og iii,
Samtidig emission af ortogonal handedness i cirkulær polariseringen, skematiske diagrammer af fremstillingsprocessen af den cirkulære polarisations-emitterende enhed (dvs. den 1. gnidning af AL22636 belagt på CuPc. ii, spin coating og tørring af F8BT lag og iii, -
 Skønhed i ufuldkommenhed:Hvordan krystaldefekter kan hjælpe med at omdanne spildvarme til elektric…Eksempler på anvendelser af elproduktion ved hjælp af termoelektrisk konvertering. Det involverer konvertering af udstødningsvarme fra bilmotorer til elektricitet til genbrug, eller bruge forskellen i
Skønhed i ufuldkommenhed:Hvordan krystaldefekter kan hjælpe med at omdanne spildvarme til elektric…Eksempler på anvendelser af elproduktion ved hjælp af termoelektrisk konvertering. Det involverer konvertering af udstødningsvarme fra bilmotorer til elektricitet til genbrug, eller bruge forskellen i -
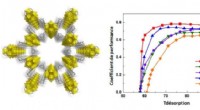 Meget effektiv køling ved hjælp af et nyt nanoporøst fast stof(venstre) Visning af strukturen af Zr-MOF (Zr-atomer/polyedre:i gult; oxygen- og hydrogenatomer i rødt og hvidt). Til højre:udvikling af ydeevnekoefficienten for MOF-Zr i sammenligning med benchmark
Meget effektiv køling ved hjælp af et nyt nanoporøst fast stof(venstre) Visning af strukturen af Zr-MOF (Zr-atomer/polyedre:i gult; oxygen- og hydrogenatomer i rødt og hvidt). Til højre:udvikling af ydeevnekoefficienten for MOF-Zr i sammenligning med benchmark -
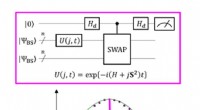 Gentænke spinkemi fra et kvanteperspektivEt kvantekredsløb, der muliggør den maksimale sandsynlighed for P(0) ved måling af parameteren J. Kredit:K. Sugisaki, K. Sato og T. Takui Forskere ved Osaka City University bruger kvantesuperposit
Gentænke spinkemi fra et kvanteperspektivEt kvantekredsløb, der muliggør den maksimale sandsynlighed for P(0) ved måling af parameteren J. Kredit:K. Sugisaki, K. Sato og T. Takui Forskere ved Osaka City University bruger kvantesuperposit
- Fjernundervisning er en model for fremtidens uddannelse
- Vedvarende Vs. Ikke-vedvarende energiressourcer
- Shanghai lufthavn automatiserer indtjekning med ansigtsgenkendelse
- Koralrev nær ækvator mindre påvirket af havets opvarmning
- Grammatikundervisning efterlader børn forvirrede, viser forskning
- Hvordan vil vi modtage signaler fra interstellare sonder som Starshot?


