Undersøgelse viser, hvordan kvindelige immunceller holder deres andet X-kromosom lukket
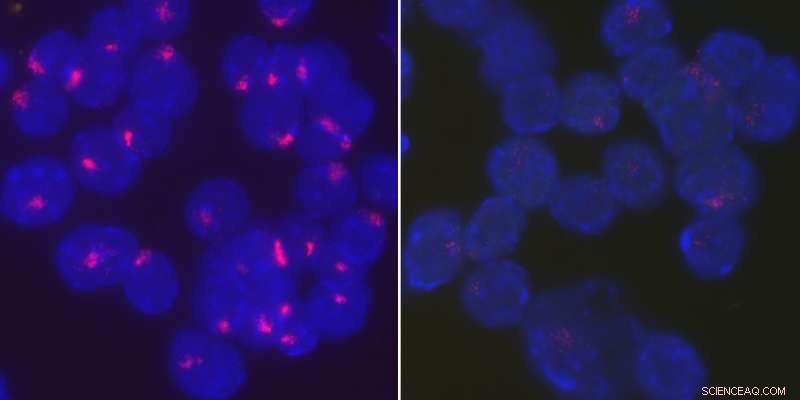
Forskere fandt ud af, at proteinet YY1 bringer Xist RNA tilbage til det inaktive X-kromosom for at opretholde X-kromosominaktivering i stimulerede B-celler. Aktiveret, vildtype B-celler fra hunmus lokaliserer Xist RNA tæt ved deres inaktive X-kromosomer (venstre), hvorimod Xist RNA bliver spredt gennem hele kernen, når YY1 er slettet (højre). Kredit:University of Pennsylvania
Autoimmune sygdomme har en tendens til at ramme kvinder mere end mænd, og det kan være hovedårsagen til at have flere X -kromosomer. Mens en proces kaldet X-kromosominaktivering tjener til at balancere gendosering mellem mænd og kvinder, nogle gener på det "inaktive X"-kromosom i immunceller kan nogle gange undslippe denne proces, give kvinder en ekstra dosis immunitetsrelateret genekspression.
I en ny undersøgelse, et hold fra University of Pennsylvania beskriver, hvordan X-kromosominaktivering reguleres i immunsystemets B-celler, når de udvikler sig i knoglemarven, og når de møder antigener. Deres arbejde belyser en dynamisk, to-trins mekanisme hos kvinder, hvorved B-celler, der mangler markørerne for X-kromosominaktivering, genvinder disse modifikationer under B-celleaktivering, i en proces, der involverer transkriptionsfaktoren YY1.
"Det bemærkelsesværdige er, at B -celler er dem, der danner antistoffer og autoantistoffer, så de er virkelig afgørende i både beskyttende immunrespons og autoimmunitet, " sagde Montserrat C. Anguera, adjunkt ved Institut for Biomedicinske Videnskaber i Penns School of Veterinary Medicine og seniorforfatter på undersøgelsen. "Et stort spørgsmål, der står tilbage er, Hvorfor er disse immunceller priming for at dette kromosom kan reguleres forskelligt og også, Hvis disse processer går galt, hvordan fører det til autoimmunitet og tab af selvtolerance?"
Studiet, udgivet i PLOS Genetik , blev ledet af Camille M. Syrett, en doktorand i Angueras laboratorium. Medforfattere, repræsenterer både Penn Vet og Penn's Perelman School of Medicine, var Vishal Sinhava, Suchita Hodawadekar, Arpita Myles, Guanxiang Liang, Yue Zhang, Satabdi Nandi, Michael Cancro og Michael Atchison.
I en undersøgelse sidste år i tidsskriftet Procedurer fra National Academy of Sciences , Anguera og kolleger fandt det naivt, ustimulerede kvindelige lymfocytter, immunsystemets B- og T-celler, mislykkedes fuldstændigt at inaktivere et X-kromosom. Forskningen viste, at dette var fordi Xist, et langt ikke-kodende RNA-transkript, der er velkendt for at initiere og vedligeholde processen med X-kromosominaktivering, kunne ikke lokalisere sig til det inaktive X -kromosom. Når immuncellerne blev aktiveret, eller klar til at reagere på infektion, Xist RNA dukkede op igen på det rigtige sted.
"Vi så, at de inaktiverede B-celler ikke har denne RNA-sky, men det kommer tilbage ved stimulering, "sagde Syrett." Vi var virkelig interesserede i at bestemme, hvad der bringer Xist RNA tilbage. "
Ved hjælp af et fluorescerende tracker-molekyle, holdet begyndte med at spore placeringen af Xist i udviklende B-celler i hunmus. De fandt ud af, at forstadierne til B-celler, såsom hæmatopoeietiske stamceller og almindelige lymfoide stamceller, havde klare mønstre af Xist RNA på det inaktive X -kromosom. Men, da disse B-celle-prækursorer gik ned ad en udviklingsvej mod at blive B-celler, Xist RNA så først ud til at forsvinde, dukker så op igen, men kun som diffuse nålestik på tværs af kernen i stedet for at være lokaliseret til det inaktive X.
Ud over, småmolekylemærker kaldet heterochromatin-modifikationer, som er kendt for at opretholde genundertrykkelse under X-krosominaktivering, forsvandt under udvikling af B-celler.
"Vi kunne se disse virkelig usædvanlige ændringer på kromatinniveauet ske i kvindelig B-celleudvikling, "Sagde Anguera.
For at finde ud af, hvordan Xisten vendte tilbage til det inaktive X ved B-celleaktivering, som de havde vist i sidste års PNAS-avis, forskerne sporede Xist RNA i B-celler i kultur. De fandt ud af, at genkomsten fandt sted i to adskilte faser:Mellem fire og 16 timer efter, at cellerne blev stimuleret, pletterne af Xist RNA begyndte at dukke op. Og mellem 16 og 30 timer efter stimulering, Xist-RNA koncentreret udelukkende ved det inaktive X-kromosom. Heterochromatin-modifikationerne så ud til at stige og lokaliseres på det inaktive X også i denne anden fase.
Holdets tidligere undersøgelse havde peget på proteinet YY1 som spiller en rolle i tilbagevenden af Xist i aktiverede B-celler, så de begyndte at se nærmere på det i dette værk. Atchison, en leder inden for undersøgelser af YY1 i B -celleudvikling, var i stand til at låne sin ekspertise til at undersøge proteinets rolle i X-kromosominaktivering.
Da forskerne undersøgte B-celler fra mus, der manglede YY1, de så stærkt reducerede niveauer af heterochromatin-mærker samt mindre lokalisering af Xist RNA til det inaktive X.
Holdet observerede også bevis for, at YY1 påvirkede ekspressionen af X-kromosomgener. Da de slettede YY1 fra mandlige og kvindelige celler og sammenlignede gener, der blev differentielt udtrykt på X -kromosomet, de fandt 68, der var specifikke for kvinder, en, der var specifik for mænd og 11, der blev delt.
Af de 68 gener, der er specifikke for hunner, mange var relateret til immunitet, og mindst to er kendt for at være overudtrykt i humane kvindelige B-celler sammenlignet med mandlige B-celler.
Et yderligere sæt eksperimenter identificerede området af YY1 med DNA-bindingsaktivitet som nøgledomænet for dette protein involveret i at bringe Xist RNA til det inaktive X.
"Det ser ud til at fungere som en tøjring, bringe Xist RNA sammen med DNA'et i det inaktive X -kromosom, " sagde Anguera.
Hun og hendes kolleger vil undersøge YY1's rolle yderligere, ved hjælp af kliniske prøver såvel som musemodeller, at se på proteinet i sygdomme som lupus for at uddybe deres forståelse af, hvordan autoimmunitet kan skyldes "flugt" af immungener fra inaktivering af X -kromosom.
"Hvis du ønsker at udvikle en terapi for autoimmune sygdomme, ideen er, Hvordan får vi Xist til det inaktive X-kromosom og holder det der, så vi opretholder dosiskompensation i disse B-celler." sagde Anguera. "YY1 ligner bestemt et virkelig lovende mål."
Sidste artikelVandstridere illustrerer evolutionære processer
Næste artikelHunde er mere udtryksfulde, når nogen kigger
 Varme artikler
Varme artikler
-
 Ny undersøgelse kortlægger prioriterede områder rundt om i verden for at beskytte pattedyrDyr med få nære slægtninge omfatter lemuren på Madagaskar. Kredit:Mathias Appel, Flickr En ny undersøgelse ledet af ANU har kortlagt prioriterede områder rundt om i verden for at beskytte tusindvi
Ny undersøgelse kortlægger prioriterede områder rundt om i verden for at beskytte pattedyrDyr med få nære slægtninge omfatter lemuren på Madagaskar. Kredit:Mathias Appel, Flickr En ny undersøgelse ledet af ANU har kortlagt prioriterede områder rundt om i verden for at beskytte tusindvi -
 Cambodja beslaglægger en forsendelse af elfenben skjult i hule træstammerCambodjanske myndigheder fremviser stykker af indsmuglet elfenben Cambodja har beslaglagt næsten et ton elfenben skjult i udhulede træstammer og fundet inde i en forladt skibscontainer, sagde en e
Cambodja beslaglægger en forsendelse af elfenben skjult i hule træstammerCambodjanske myndigheder fremviser stykker af indsmuglet elfenben Cambodja har beslaglagt næsten et ton elfenben skjult i udhulede træstammer og fundet inde i en forladt skibscontainer, sagde en e -
 Bakterier får modstand fra konkurrenterBakteriekonkurrence i mikroskala:T6SS (grøn, magenta) medieret drab og lysis af konkurrerende bakterier kan føre til DNA-frigivelse (cyan) og efterfølgende genoverførsel. Kredit:Universität Basel
Bakterier får modstand fra konkurrenterBakteriekonkurrence i mikroskala:T6SS (grøn, magenta) medieret drab og lysis af konkurrerende bakterier kan føre til DNA-frigivelse (cyan) og efterfølgende genoverførsel. Kredit:Universität Basel -
 Din hjerne på: EmpatiHar du nogensinde bemærket, hvordan nogens positivitet og entusiasme er smitsom? Eller hvordan en andens smerte eller frygt også får dig til at føle bekymring? Det er empati på arbejdet. Ikke k
Din hjerne på: EmpatiHar du nogensinde bemærket, hvordan nogens positivitet og entusiasme er smitsom? Eller hvordan en andens smerte eller frygt også får dig til at føle bekymring? Det er empati på arbejdet. Ikke k


