Hvordan forestilte Dalton atomet?
Her er en sammenbrud af hans vigtigste ideer:
* udelelig og uforglemmelig: Dalton troede, at atomer ikke kunne opdeles i mindre partikler.
* Unikke egenskaber: Hvert element var sammensat af identiske atomer med specifikke egenskaber, som masse, størrelse og reaktivitet.
* Kombination i hele talforhold: Når elementer kombinerede for at danne forbindelser, gjorde de det i enkle, hele antal forhold (loven i flere proportioner).
Hans model var baseret på:
* Observationer af kemiske reaktioner: Dalton bemærkede, at elementer altid kombineret i faste forhold, hvilket antydede eksistensen af diskrete enheder.
* loven om bevarelse af masse: Massen er hverken skabt eller ødelagt i kemiske reaktioner.
* Loven om bestemte proportioner: En given kemisk forbindelse indeholder altid de samme elementer i den samme andel af masse.
Begrænsninger af Daltons model:
* Ingen intern struktur: Daltons model tog ikke højde for de subatomære partikler (protoner, neutroner og elektroner), der senere blev opdaget.
* forenklet repræsentation: Det forklarede ikke de forskellige kemiske egenskaber ved elementer.
På trods af sine begrænsninger var Daltons model et betydeligt gennembrud i vores forståelse af stof. Det gav en grundlæggende ramme for yderligere udvikling af atomteori.
Sidste artikelHvad udtrykkes normalt med en kemisk formel?
Næste artikelHvad er metallet af en pære lavet af?
 Varme artikler
Varme artikler
-
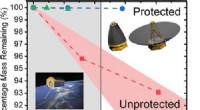 Gennembrudsmateriale kan beskytte satellitter mod ultraviolet stråling og atomært ilt i en bane ud…Kredit:ACS Atomisk ilt dannes, når O 2 molekyler går i stykker, en proces gjort lettere i rummet på grund af overflod af ultraviolet stråling. Ifølge NASA, 96 procent af lav-jordens kredsløbets
Gennembrudsmateriale kan beskytte satellitter mod ultraviolet stråling og atomært ilt i en bane ud…Kredit:ACS Atomisk ilt dannes, når O 2 molekyler går i stykker, en proces gjort lettere i rummet på grund af overflod af ultraviolet stråling. Ifølge NASA, 96 procent af lav-jordens kredsløbets -
 Forskere skaber ultraletvægts keramisk materiale, der modstår ekstreme temperaturerEt optisk billede, der viser en hBNAG-prøve hvilende på støvdrageren af en blomst. Kredit:X. Xu og X. Duan UCLA-forskere og samarbejdspartnere ved otte andre forskningsinstitutioner har skabt et
Forskere skaber ultraletvægts keramisk materiale, der modstår ekstreme temperaturerEt optisk billede, der viser en hBNAG-prøve hvilende på støvdrageren af en blomst. Kredit:X. Xu og X. Duan UCLA-forskere og samarbejdspartnere ved otte andre forskningsinstitutioner har skabt et -
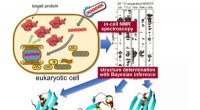 In-situ måling af 3-D proteinstruktur inde i levende eukaryote cellerMålproteiner udtrykkes indeni sf9 celler, derefter målt under anvendelse af in-cell NMR-spektroskopi. Unik statistisk analyse ved hjælp af Bayesiansk slutning anvendes til at beregne den nøjagtige
In-situ måling af 3-D proteinstruktur inde i levende eukaryote cellerMålproteiner udtrykkes indeni sf9 celler, derefter målt under anvendelse af in-cell NMR-spektroskopi. Unik statistisk analyse ved hjælp af Bayesiansk slutning anvendes til at beregne den nøjagtige -
 Hvordan man forhindrer katodisk korrosion af metalelektroder i elektroorganisk synteseGrafisk abstrakt. Kredit:DOI:10.1021/acs.chemrev.1c00148 Bæredygtighed er et vigtigt emne i erhvervslivet i disse dage. Mange virksomheder erkender behovet for at finde de bedst mulige klimaneutra
Hvordan man forhindrer katodisk korrosion af metalelektroder i elektroorganisk synteseGrafisk abstrakt. Kredit:DOI:10.1021/acs.chemrev.1c00148 Bæredygtighed er et vigtigt emne i erhvervslivet i disse dage. Mange virksomheder erkender behovet for at finde de bedst mulige klimaneutra


