Hvad udtrykkes normalt med en kemisk formel?
1. Elementerne til stede i et stof: Det viser symbolerne på de elementer, der udgør stoffet. For eksempel indikerer H₂O, at vand indeholder brint (H) og ilt (O).
2. Det relative antal atomer i hvert element: Underskrifterne, der følger hvert elementsymbol, angiver antallet af atomer i dette element i et molekyle eller formelenhed for stoffet. I H₂O indikerer underskriften '2', at der er to hydrogenatomer for hvert iltatom.
3. Den type binding mellem atomer: Formlen kan undertiden antyde den tilstedeværende bindingstype. F.eks. Er ioniske forbindelser typisk repræsenteret af deres empiriske formel (enkleste hele antal atomer), mens kovalente forbindelser ofte bruger molekylære formler, der viser det faktiske antal atomer i et molekyle.
4. Stoffets molekylvægt: Ved at tilføje atommasserne af alle atomer i formlen, kan vi beregne molekylvægten af forbindelsen.
5. Stoffets kemiske egenskaber: Formlen kan bruges til at forudsige visse egenskaber ved stoffet, såsom dets reaktivitet eller dets smeltepunkt.
Imidlertid udtrykker en kemisk formel ikke altid:
* Det faktiske arrangement af atomer i rummet: For eksempel kan formlen C₂H₆ repræsentere både ethan og propan, som har forskellige strukturer.
* stoffets fysiske tilstand: En formel fortæller dig ikke, om et stof er en fast, væske eller gas ved en given temperatur og tryk.
* den kemiske reaktion, der producerede stoffet: Mens formlen kan antyde mulige reaktioner, giver den dig ikke de specifikke trin, der er involveret i dens dannelse.
Selvom kemiske formler er meget nyttige til at opsummere sammensætningen af stoffer, formidler de ikke alle aspekter af en kemisk forbindelse.
 Varme artikler
Varme artikler
-
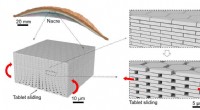 Ny type glas inspireret af naturen er mere modstandsdygtig over for stødMikroarkitekturen af Nacre og tablet, der glider i Nacre. Kredit:Z. Yin, F. Hannard, F. Barthelat Ved at bruge den iriserende perlemor, der ofte findes foring af muslingeskaller, forskere har ko
Ny type glas inspireret af naturen er mere modstandsdygtig over for stødMikroarkitekturen af Nacre og tablet, der glider i Nacre. Kredit:Z. Yin, F. Hannard, F. Barthelat Ved at bruge den iriserende perlemor, der ofte findes foring af muslingeskaller, forskere har ko -
 Hybridmateriale kan overgå grafen i flere applikationerEn struktur, der omfatter et molybdændisulfid-monolag på et azobenzen-substrat, kunne bruges til at bygge en meget komprimerbar og formbar kvasi-to-dimensionel transistor drevet af lys. Kredit:atomist
Hybridmateriale kan overgå grafen i flere applikationerEn struktur, der omfatter et molybdændisulfid-monolag på et azobenzen-substrat, kunne bruges til at bygge en meget komprimerbar og formbar kvasi-to-dimensionel transistor drevet af lys. Kredit:atomist -
 Smartphone lab leverer testresultater på spyt sekundProfessor Chong Ahn fra University of Cincinnati udviklede et bærbart laboratorium, der tilsluttes din smartphone for at diagnosticere sygdomme som malaria eller coronavirus. Resultaterne overføres ti
Smartphone lab leverer testresultater på spyt sekundProfessor Chong Ahn fra University of Cincinnati udviklede et bærbart laboratorium, der tilsluttes din smartphone for at diagnosticere sygdomme som malaria eller coronavirus. Resultaterne overføres ti -
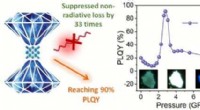 Opnå 90% PL-kvanteudbytte i 1-D metalhalogenid ved trykundertrykt ikke-strålende tabKredit:Center for High Pressure Science &Technology Advanced Research Lavdimensionelle perovskit-relaterede metalhalogenider er opstået som en ny klasse af lysemitterende materialer med afstemt br
Opnå 90% PL-kvanteudbytte i 1-D metalhalogenid ved trykundertrykt ikke-strålende tabKredit:Center for High Pressure Science &Technology Advanced Research Lavdimensionelle perovskit-relaterede metalhalogenider er opstået som en ny klasse af lysemitterende materialer med afstemt br


