Hvis et atom som brint er i stand til at danne en kovalent binding, beskriver hvad der sker, når elektronskaller af to atomer overlapper hinanden?
1. Det grundlæggende
* Hydrogen's struktur: Hydrogen har en proton og en elektron. Dens elektronkonfiguration er 1S¹, hvilket betyder, at den har en elektron i sin første elektronskal.
* kovalent binding: Kovalente bindinger dannes, når to atomer deler elektroner for at opnå en mere stabil elektronkonfiguration. Denne deling giver hvert atom mulighed for effektivt at fylde sin yderste elektronskal.
2. Overlappende elektronskaller
* attraktion: Når to hydrogenatomer nærmer sig hinanden, tiltrækker deres positivt ladede kerner de negativt ladede elektroner fra det andet atom.
* Shell Overlapning: Efterhånden som atomerne kommer nærmere, begynder deres 1s elektronskaller at overlappe hinanden. Dette betyder, at elektronerne fra hvert atom nu er inden for påvirkningen af begge kerner.
* Elektrondeling: Overlapningen af elektronskaller tillader de to elektroner (en fra hvert hydrogenatom) at blive lokaliseret i regionen mellem de to kerner. Dette delte par elektroner tiltrækkes nu af begge kerner, der holder atomerne sammen.
3. Resultatet:En kovalent binding
* stabilitet: De delte elektroner fylder effektivt begge hydrogenatomer 'yderste elektronskaller og opnår en stabil, ædel gaslignende konfiguration.
* lavere energi: Deling af elektroner reducerer systemets samlede energi, hvilket gør bindingen stabil.
* H2 -molekylet: De to hydrogenatomer findes nu som et enkelt molekyle, H2.
Visualisering af det:
Forestil dig to balloner, der hver repræsenterer et hydrogenatom. Ballonerne har en enkelt streng fastgjort til hver, der repræsenterer elektronet. Når ballonerne bringes tæt på, overlapper strengene (elektronerne) og bliver sammenfiltrede. De sammenfiltrede strenge repræsenterer de delte elektroner og holder de to balloner (hydrogenatomer) sammen.
Vigtig note: Denne beskrivelse forenkler konceptet. Den faktiske elektronadfærd styres af kvantemekanik, der beskriver elektronerne som sandsynlighedsskyer snarere end forskellige punkter. Imidlertid forbliver den grundlæggende idé om delte elektroner og en stabil konfiguration den samme.
Sidste artikelEr N2 et fast stof ved stuetemperatur?
Næste artikelHvad udtrykkes normalt med en kemisk formel?
 Varme artikler
Varme artikler
-
 Innovation spinder edderkoppespindarkitektur til 3-D billedteknologiEt edderkoppespind-inspireret fraktalt design bruges til halvkugleformet 3D-fotodetektion for at replikere synssystemet hos leddyr. Kredit:Sena Huh/Purdue University Purdue University innovatører
Innovation spinder edderkoppespindarkitektur til 3-D billedteknologiEt edderkoppespind-inspireret fraktalt design bruges til halvkugleformet 3D-fotodetektion for at replikere synssystemet hos leddyr. Kredit:Sena Huh/Purdue University Purdue University innovatører -
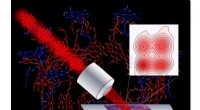 Forskere udvikler mikroskop til at spore lysenergistrøm i fotosyntetiske cellerAnvender en række ultrakorte laserpulser, et nyt mikroskop afslører indviklede detaljer, der styrer fotosyntetiske processer i lilla bakterier. Kredit:Vivek Tiwari, Yassel Acosta og Jennifer Ogilvie
Forskere udvikler mikroskop til at spore lysenergistrøm i fotosyntetiske cellerAnvender en række ultrakorte laserpulser, et nyt mikroskop afslører indviklede detaljer, der styrer fotosyntetiske processer i lilla bakterier. Kredit:Vivek Tiwari, Yassel Acosta og Jennifer Ogilvie -
 Strontium-iridiumoxid bruges til tilpasning som elektronisk materialeThorsten Schmitt (til venstre) og Milan Radovic på deres forsøgsstation ved Swiss Light Source SLS, hvor de udførte deres målinger på tynde film af strontium-iridiumoxid. Kredit:Paul Scherrer Institut
Strontium-iridiumoxid bruges til tilpasning som elektronisk materialeThorsten Schmitt (til venstre) og Milan Radovic på deres forsøgsstation ved Swiss Light Source SLS, hvor de udførte deres målinger på tynde film af strontium-iridiumoxid. Kredit:Paul Scherrer Institut -
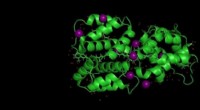 Vores første kig på et nyt lysabsorberende protein i cyanobakterierKredit:Michigan State University Cyanobakterier er små, hårdføre organismer. Hver celle er 25 gange mindre end et menneskehår, men lad ikke størrelsen narre dig. Deres kollektive evne til at udvid
Vores første kig på et nyt lysabsorberende protein i cyanobakterierKredit:Michigan State University Cyanobakterier er små, hårdføre organismer. Hver celle er 25 gange mindre end et menneskehår, men lad ikke størrelsen narre dig. Deres kollektive evne til at udvid
- Hvad er oxidationstallet for C i glukose?
- Hvordan bruger arkitekter videnskab?
- Tilbagetrækning af Antarktis indlandsis kan udløse kædereaktion
- Når månen ikke er synlig på grund af skygge?
- Smukt meget stort mock orange træ, du mener er over 30 år et par grene, som bladene er helt døde …
- Elektroner pytter under høje magnetfelter, undersøgelse afslører


