Er et udtryk, der bruges til at descibe et elektrisk neutralt molekyle dannet af kovalente bindinger mellem atomer, der har den lignende elektronegativitet?
Her er hvorfor:
* Elektrisk neutralt molekyle: Kovalente bindinger involverer deling af elektroner, så molekylet som helhed forbliver elektrisk neutral.
* kovalente bindinger mellem atomer med lignende elektronegativitet: Når atomer har lignende elektronegativitet, deler de elektroner lige. Dette betyder, at der ikke er nogen signifikant forskel i elektrondensitet omkring hvert atom, hvilket resulterer i en ikke -polær binding.
Eksempler på ikke -polære kovalente obligationer:
* H₂ (brintgas): Begge hydrogenatomer har den samme elektronegativitet.
* cl₂ (klorgas): Begge kloratomer har den samme elektronegativitet.
* o₂ (iltgas): Begge iltatomer har den samme elektronegativitet.
Vigtig note: Mens et molekyle med ikke -polære kovalente bindinger generelt betragtes som ikke -polær, er den samlede molekylære form spiller også en rolle i bestemmelsen af polaritet. For eksempel har CO₂ to polære kovalente bindinger, men er et lineært molekyle, hvilket gør det samlet ikke -polært.
Sidste artikelHvad er kemi, og hvad i dine daglige liv?
Næste artikelHvad er pH for guldtestopløsning?
 Varme artikler
Varme artikler
-
 Superstrong Al -legeringer kan ændre fremstillingsprocesser til biler, rumfartsudstyrPå dette bilede, Qiang Li laver et afsætningsprogram på den operationelle computer, og Yifan Zhang indlæser prøver i et sputterkammer for at forberede højstyrke Al-legeringsbelægninger. Kredit:Purdue
Superstrong Al -legeringer kan ændre fremstillingsprocesser til biler, rumfartsudstyrPå dette bilede, Qiang Li laver et afsætningsprogram på den operationelle computer, og Yifan Zhang indlæser prøver i et sputterkammer for at forberede højstyrke Al-legeringsbelægninger. Kredit:Purdue -
 Teknik afslører, hvordan krystaller dannes på overfladerProcessen med hvordan krystaller dannes på en flad overflade, som vist på dette elektronmikroskopbillede, har været svært at studere i detaljer indtil nu. Kredit:Robert Macfarlane Krystallisations
Teknik afslører, hvordan krystaller dannes på overfladerProcessen med hvordan krystaller dannes på en flad overflade, som vist på dette elektronmikroskopbillede, har været svært at studere i detaljer indtil nu. Kredit:Robert Macfarlane Krystallisations -
 Brug af stamme til at kontrollere oxynitrid -egenskaberForskere fandt en måde at oprette og kontrollere retningen og periodiciteten af ilt-ledige lag i oxynitridkrystaller ved en temperatur så lav som 600 ° C. Kredit:Mindy Takamiya/Kyoto University iCeM
Brug af stamme til at kontrollere oxynitrid -egenskaberForskere fandt en måde at oprette og kontrollere retningen og periodiciteten af ilt-ledige lag i oxynitridkrystaller ved en temperatur så lav som 600 ° C. Kredit:Mindy Takamiya/Kyoto University iCeM -
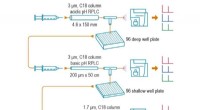 Forbedret proteinanalyse kan hjælpe med tidlig sygdomsdetektionPNNLs dybdyk-SRM-metode tilbyder en ny måde at forberede og analysere blodprøver på, og gør det muligt at påvise proteiner, der findes i meget lave koncentrationer – så lidt som 10 pikogram pr. millil
Forbedret proteinanalyse kan hjælpe med tidlig sygdomsdetektionPNNLs dybdyk-SRM-metode tilbyder en ny måde at forberede og analysere blodprøver på, og gør det muligt at påvise proteiner, der findes i meget lave koncentrationer – så lidt som 10 pikogram pr. millil
- Hvilken af disse er en voldelig storm på solen, der har enorme skyer store lyse sløjfer eller bu…
- Tror de fleste amerikanere på menneskeskabte klimaændringer?
- Hvad er en død stjerne med densiteten af en atomkerner kaldet?
- Hvilke gener kan overføres ved alle tre metoder til intermikrobiel overførsel?
- FN bekræfter rekordvarme på 18,3C i Antarktis
- Undersøgelse binder fosforbelastning i søer til ekstreme nedbørshændelser


