Er det sandt, at for at finde det samlede antal elektroner, der er tilgængelige til binding i en positiv ion, skal du tilføje ladningsvalensatomer til stede?
Her er hvorfor:
* Valenselektroner er nøglen: Du har ret i at fokusere på valenselektroner. Dette er de yderste elektroner, og det er dem, der er involveret i kemisk binding.
* positive ioner mister elektroner: En positiv ion dannes, når et atom * mister * en eller flere elektroner.
* ladningen fortæller dig, hvor mange elektroner der går tabt: Anklagen for den positive ion indikerer direkte antallet af mistede elektroner. For eksempel betyder en +2 ladning, at atomet mistede 2 elektroner.
For at finde antallet af elektroner, der er tilgængelige til binding i en positiv ion, skal du derfor:
1. Bestem antallet af valenselektroner i det neutrale atom.
2. Træk antallet af mistede elektroner, hvilket er lig med størrelsen af den positive ladning.
Eksempel:
Lad os tage eksemplet på en magnesiumion (mg²⁺):
1. Magnesium (Mg) har 2 valenselektroner.
2. mg²⁺ har en +2 ladning, hvilket betyder, at det mistede 2 elektroner.
3. Derfor har mg²⁺ 0 Valenselektroner til rådighed til limning.
Vigtig note: Mens en positiv ion har færre valenselektroner end dets neutrale atom, er den stadig i stand til at danne bindinger. Dette skyldes, at det kan danne ioniske bindinger ved at tiltrække negativt ladede ioner.
I sammendraget findes antallet af elektroner, der er tilgængelige til binding i en positiv ion, ved at trække størrelsen af den positive ladning fra antallet af valenselektroner i det neutrale atom.
Sidste artikelEr zinkcarbonat et uopløseligt salt?
Næste artikelHvordan bliver et atom en positiv ion -nevativ ion?
 Varme artikler
Varme artikler
-
 Nano-svampe af fast syre omdanner kuldioxid til brændstof og plastikaffald til kemikalierNanofaste syrer, der omdanner kuldioxid direkte til brændstof (dimethylether) og plastaffald til kemikalier (kulbrinter). Kredit:Ayan Maity, TIFR, Mumbai Den primære årsag til klimaændringer er at
Nano-svampe af fast syre omdanner kuldioxid til brændstof og plastikaffald til kemikalierNanofaste syrer, der omdanner kuldioxid direkte til brændstof (dimethylether) og plastaffald til kemikalier (kulbrinter). Kredit:Ayan Maity, TIFR, Mumbai Den primære årsag til klimaændringer er at -
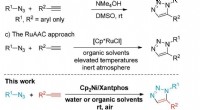 Team præsenterer ny syntesemetode til klikkemiSammenligningen af den eksisterende syntesemetode og den nyudviklede syntesemetode af professor Hong. Kredit:UNIST En nylig undersøgelse foretaget af forskere tilknyttet UNIST har præsenteret en
Team præsenterer ny syntesemetode til klikkemiSammenligningen af den eksisterende syntesemetode og den nyudviklede syntesemetode af professor Hong. Kredit:UNIST En nylig undersøgelse foretaget af forskere tilknyttet UNIST har præsenteret en -
 Forskere dechifrerer strukturen af lovende metalorganiske rammerForskere ved MIT og andre institutioner har fundet en måde at stabilisere væksten af krystaller af flere slags metalorganiske rammer, eller MOFer. Dette billede viser to scanning elektronmikroskopi
Forskere dechifrerer strukturen af lovende metalorganiske rammerForskere ved MIT og andre institutioner har fundet en måde at stabilisere væksten af krystaller af flere slags metalorganiske rammer, eller MOFer. Dette billede viser to scanning elektronmikroskopi -
 Samarbejde giver lovende innovation inden for pletbestandighedPrøver af klud både ubehandlet, venstre, og behandlet med en fluor-fri oleofob belægning udviklet i laboratorier af Emmanuel Giannelis, professor i materialevidenskab og teknik, og Jintu Fan, professo
Samarbejde giver lovende innovation inden for pletbestandighedPrøver af klud både ubehandlet, venstre, og behandlet med en fluor-fri oleofob belægning udviklet i laboratorier af Emmanuel Giannelis, professor i materialevidenskab og teknik, og Jintu Fan, professo


