Hvordan vil du retfærdiggøre, at vand er en forbindelse, der ikke er blanding?
1. Fast sammensætning:
* Forbindelser: Har et fast og bestemt forhold mellem elementer. Vand indeholder altid to hydrogenatomer og et iltatom pr. Molekyle (H₂O). Dette forhold ændres aldrig.
* Blandinger: Kan have forskellige sammensætninger. For eksempel kan saltvand have forskellige mængder salt opløst i vand.
2. Kemisk binding:
* Forbindelser: Dannet af kemiske bindinger mellem atomer. I vand deler brint- og iltatomer elektroner og danner en stærk kovalent binding.
* Blandinger: Ingen kemiske bindinger dannes mellem komponenter. I saltvand opløses saltkrystallerne simpelthen i vandet, ikke kemisk kombineret.
3. Egenskaber:
* Forbindelser: Har unikke egenskaber, der er forskellige fra deres bestanddele. Vand er en væske ved stuetemperatur, mens brint er en gas, og ilt er en gas.
* Blandinger: Bevar egenskaberne for deres individuelle komponenter. Saltvand smager stadig salt, fordi det indeholder salt, og det er stadig flydende, fordi det indeholder vand.
4. Adskillelse:
* Forbindelser: Kan kun adskilles med kemiske reaktioner og bryde bindingerne. Elektrolyse kan adskille vand i brint og iltgas.
* Blandinger: Kan adskilles med fysiske midler, såsom fordampning, filtrering eller destillation. Saltvand kan adskilles ved fordampning og efterlader saltet.
5. Homogenitet:
* Forbindelser: Er homogene, hvilket betyder, at de har en ensartet sammensætning overalt. Vand er det samme i hele sit volumen.
* Blandinger: Kan være homogen (som saltvand) eller heterogen (som sand og vand).
I resumé peger vandets faste sammensætning, kemisk binding, unikke egenskaber, krav om kemiske metoder til adskillelse og homogenitet alle på det at være en forbindelse, ikke en blanding.
Sidste artikelHvad gør uorganisk kemiker?
Næste artikelEr 3-methyl-1-butyne en fast væske eller gas?
 Varme artikler
Varme artikler
-
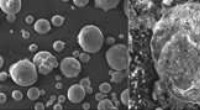 En hårdere ledende keramik til lavere omkostningerScanningselektronmikrofotografier, der viser (venstre mod højre) de rå Ti-partikler, de fladtrykte Ti-partikler efter formaling, og det endelige sintrede Al 2 O 3 -TiN ledende komposit. Kredit:W.
En hårdere ledende keramik til lavere omkostningerScanningselektronmikrofotografier, der viser (venstre mod højre) de rå Ti-partikler, de fladtrykte Ti-partikler efter formaling, og det endelige sintrede Al 2 O 3 -TiN ledende komposit. Kredit:W. -
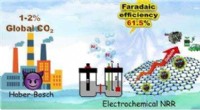 Fremskridt i den billige elektrokemiske syntese af ammoniakVed at efterligne nogle af egenskaberne ved nitrogenase, forskere udviklede en elektrokatalysator, der er i stand til at producere ammoniak fra atmosfærisk nitrogen. Dette kunne hjælpe os med at styre
Fremskridt i den billige elektrokemiske syntese af ammoniakVed at efterligne nogle af egenskaberne ved nitrogenase, forskere udviklede en elektrokatalysator, der er i stand til at producere ammoniak fra atmosfærisk nitrogen. Dette kunne hjælpe os med at styre -
 Forskere udvikler hurtig kemi, der låser op for en ny klasse af polymererForskere har udviklet en kemisk proces, der kan gøre en klasse af polymerer kendt som polysulfater mere konkurrencedygtige med polycarbonater - robust plast, der kan danne strukturelle paneler som dem
Forskere udvikler hurtig kemi, der låser op for en ny klasse af polymererForskere har udviklet en kemisk proces, der kan gøre en klasse af polymerer kendt som polysulfater mere konkurrencedygtige med polycarbonater - robust plast, der kan danne strukturelle paneler som dem -
 Potentielle antimikrobielle fundet, der viser løfte om bekæmpelse af stafylokokinfektionerEric Brown (til venstre), professor i biokemi og biomedicinsk videnskab, og Omar El-Halfawy, en postdoc i biokemi og biomedicinske videnskaber, ved McMaster University. Kredit:McMaster University
Potentielle antimikrobielle fundet, der viser løfte om bekæmpelse af stafylokokinfektionerEric Brown (til venstre), professor i biokemi og biomedicinsk videnskab, og Omar El-Halfawy, en postdoc i biokemi og biomedicinske videnskaber, ved McMaster University. Kredit:McMaster University
- Racemæssig modvilje gav næring til oprøret 6. januar og modstand mod husets undersøgelse, finder…
- Nanopartikler samlet inde i tumorer fanger lægemidler og billeddannende midler
- Hvad skal påføres et objekt for at ændre bevægelsen eller retningen?
- Økonomer indkasserer effektive, højtydende computermetode
- Hvorfor bevæger stængel og rod sig mod henholdsvis let tyngdepunkt jorden?
- Er gravitationskræfter og accelerationsækvivalent?


