Hvad er de ydre elektroner, der er involveret i binding?
Her er en sammenbrud:
* Elektroner i atomer: Atomer består af en kerne (indeholdende protoner og neutroner) omgivet af skaller af elektroner.
* Elektronskaller: Disse skaller repræsenterer forskellige energiniveauer. Elektroner i ydre skaller har højere energi end i indre skaller.
* Valence Shell: Den yderste skal af et atom kaldes valensskallen.
* Valenselektroner: Elektronerne, der findes i valensskallen, er valenselektronerne. Dette er de elektroner, der mest sandsynligt deltager i kemisk binding.
Hvorfor er valenselektroner involveret i binding?
* stabilitet: Atomer stræber efter en stabil elektronkonfiguration, der ofte ligner de ædle gasser, der har fulde valensskaller.
* Deling eller overførsel: For at opnå stabilitet kan atomer enten dele deres valenselektroner med andre atomer (kovalent binding) eller overføre dem til andre atomer (ionisk binding).
Eksempel:
* carbon (c): Carbon har 6 elektroner. Dens elektroniske konfiguration er 2, 4. Dette betyder, at den har 4 valenselektroner i sin ydre skal. Disse 4 elektroner er involveret i dannelsen af bindinger.
* ilt (O): Oxygen har 8 elektroner. Dens elektroniske konfiguration er 2, 6. Dette betyder, at den har 6 valenselektroner i sin ydre skal og har en tendens til at vinde 2 flere elektroner for at opnå en stabil oktet.
Forståelse af valenselektroner er afgørende for at forudsige, hvordan atomer vil interagere og danne kemiske bindinger.
Sidste artikelHvad er de forventede produkter fra tloh plus CO2?
Næste artikelMolekylær ligning til forbrænding af metangas?
 Varme artikler
Varme artikler
-
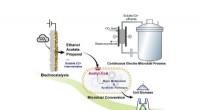 Teamet designer system til at skabe bioplastGrafisk abstrakt. Kredit:Chem (2022). DOI:10.1016/j.chempr.2022.09.005 Et team af Texas A&M AgriLife Research-forskere har udviklet et system, der bruger kuldioxid, CO2 , for at producere bionedbry
Teamet designer system til at skabe bioplastGrafisk abstrakt. Kredit:Chem (2022). DOI:10.1016/j.chempr.2022.09.005 Et team af Texas A&M AgriLife Research-forskere har udviklet et system, der bruger kuldioxid, CO2 , for at producere bionedbry -
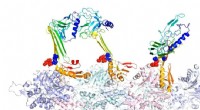 Protein kamæleon farver langtidshukommelsenForskere ved Rice University modellerede bindingsstrukturerne af actin og associerede proteiner, som de mener er ansvarlige for dannelsen af langtidshukommelse. Her, beta-hårnåleformen af lynlåsse
Protein kamæleon farver langtidshukommelsenForskere ved Rice University modellerede bindingsstrukturerne af actin og associerede proteiner, som de mener er ansvarlige for dannelsen af langtidshukommelse. Her, beta-hårnåleformen af lynlåsse -
 I felttest, enheden høster vand fra ørkenluftenKredit:CC0 Public Domain Det ser ud til at få noget for ingenting, men du kan virkelig få drikkevand lige ud af den tørreste af ørkenluft. Selv på de mest tørre steder på Jorden, der er lidt fugt
I felttest, enheden høster vand fra ørkenluftenKredit:CC0 Public Domain Det ser ud til at få noget for ingenting, men du kan virkelig få drikkevand lige ud af den tørreste af ørkenluft. Selv på de mest tørre steder på Jorden, der er lidt fugt -
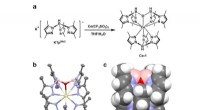 Dybblå organiske lysemitterende dioder baseret på et dublet-emission cerium(III) kompleksen. Syntetisk rute for komplekset. b. Enkeltkrystalstruktur af komplekset vist som ellipsoider ved 50 % sandsynlighedsniveau, hvor gul repræsenterer Ce, pink repræsenterer B, blå repræsenterer N, rød
Dybblå organiske lysemitterende dioder baseret på et dublet-emission cerium(III) kompleksen. Syntetisk rute for komplekset. b. Enkeltkrystalstruktur af komplekset vist som ellipsoider ved 50 % sandsynlighedsniveau, hvor gul repræsenterer Ce, pink repræsenterer B, blå repræsenterer N, rød


