Hvad er en ikke -polær aminosyre?
Her er en sammenbrud:
* aminosyrer: Byggestenene af proteiner. De har alle et centralt carbonatom (alfa carbon) bundet til en aminogruppe (NH2), en carboxylgruppe (COOH), et hydrogenatom (H) og en sidekæde (R -gruppe).
* sidekæde (R-gruppe): Den del af aminosyren, der giver den sine unikke egenskaber.
* ikke-polær: Betyder, at sidekæden ikke interagerer godt med vand. Dette skyldes, at sidekæden består af kulbrinter, som primært er kulstof- og brintatomer. Carbon og brint har lignende elektronegativitet, hvilket betyder, at de deler elektroner relativt lige. Dette resulterer i et molekyle, der ikke er polært.
Eksempler på ikke-polære aminosyrer:
* glycin (Gly, G): Enkleste aminosyre med kun et hydrogenatom som dens sidekæde.
* alanin (ala, a): Har en methylgruppe (CH3) som dens sidekæde.
* Valine (Val, V): Har en forgrenet carbonhydridkæde.
* leucin (leu, l): Svarende til valin, men med et ekstra carbonatom.
* isoleucin (ile, i): En anden forgrenet carbonhydridkæde.
* proline (pro, p): Unik cyklisk struktur.
* phenylalanin (Phe, F): Indeholder en benzenring.
* methionin (Met, M): Indeholder et svovlatom.
* tryptophan (Trp, W): Indeholder en dobbelt-ringstruktur.
Betydningen af ikke-polære aminosyrer:
* Proteinfoldning: Ikke-polære aminosyrer har en tendens til at klynge sig sammen i det indre af proteiner væk fra vandet. Denne hydrofobe interaktion er en vigtig drivkraft i proteinfoldning.
* membranproteiner: Ikke-polære aminosyrer findes ofte i transmembrane regioner af proteiner, hvilket giver dem mulighed for at interagere med det hydrofobe miljø i cellemembranen.
* funktion: Hydrofobiciteten af ikke-polære aminosyrer kan påvirke funktionen af proteiner, såsom i enzymaktivitet eller protein-proteininteraktioner.
Fortæl mig, hvis du gerne vil have flere detaljer om enhver specifik ikke-polær aminosyre!
Sidste artikelHvor mange mol Mg er 2,01 gange 10x22 atomer?
Næste artikelHvordan passerer opløste molekyler gennem membranen?
 Varme artikler
Varme artikler
-
 Forskere patenterer hurtige tests for kokainFIU biokemi Ph.D. studerende Haixiang Yu, kemi Ph.D. studerende Juan Canoura, og nyuddannet Obtin Alkhamis offentliggjorde en undersøgelse af FIUs patenterede kokaindetektionsteknologier. Kredit:Flori
Forskere patenterer hurtige tests for kokainFIU biokemi Ph.D. studerende Haixiang Yu, kemi Ph.D. studerende Juan Canoura, og nyuddannet Obtin Alkhamis offentliggjorde en undersøgelse af FIUs patenterede kokaindetektionsteknologier. Kredit:Flori -
 Flåtprotein hjælper antibiotika med at bekæmpe MRSA super bugKredit:stock.adobe.com Et protein afledt af flåter øger effektiviteten af antibiotikabehandling af methicillin-resistente Staphylococcus aureus, eller MRSA, ifølge en undersøgelse ledet af Yale.
Flåtprotein hjælper antibiotika med at bekæmpe MRSA super bugKredit:stock.adobe.com Et protein afledt af flåter øger effektiviteten af antibiotikabehandling af methicillin-resistente Staphylococcus aureus, eller MRSA, ifølge en undersøgelse ledet af Yale. -
 Kemikere identificerer giftige kemikalier i fracking spildevandDr. Emanuela Gionfriddo, adjunkt i analytisk kemi, og Ronald Emmons, UToledo Ph.D. kandidat, undersøger vandkvaliteten og miljøhensyn ved fracking af spildevand for at afgøre, om det er sikkert at gen
Kemikere identificerer giftige kemikalier i fracking spildevandDr. Emanuela Gionfriddo, adjunkt i analytisk kemi, og Ronald Emmons, UToledo Ph.D. kandidat, undersøger vandkvaliteten og miljøhensyn ved fracking af spildevand for at afgøre, om det er sikkert at gen -
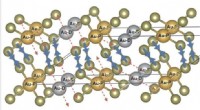 Forskere løser det gyldne puslespil med kalaveritDannelse af Te-Te dimererne på grund af ladningsdisproportionering på Au-steder. Kredit:S. V. Streltsov et al./ PNAS Forskere fra Rusland og Tyskland har kastet lys over den krystallinske strukt
Forskere løser det gyldne puslespil med kalaveritDannelse af Te-Te dimererne på grund af ladningsdisproportionering på Au-steder. Kredit:S. V. Streltsov et al./ PNAS Forskere fra Rusland og Tyskland har kastet lys over den krystallinske strukt
- Forskere udvikler stresstest til at forudsige, hvordan kiselalger vil reagere på havforsuring
- Hvilke teknologier påvirker brugen af geotermisk energi?
- Metan siver stadig fra jorden på stedet for gaseksplosionen for årtier siden
- Hvad hedder mikroskop, der hovedsageligt bruges i klasseværelset?
- Nogle mennesker føler, at den ideelle temperatur for kontorlokaler er 72 grader Fahrenheit Hvad i C…
- Er mekanisk energi en vektorkvalitet?


