Hvor mange elektroner er der i den anden skal af ion Br -1?
1. Elektronisk konfiguration af brom (BR)
* Brom har et atomnummer på 35, hvilket betyder, at det har 35 protoner og 35 elektroner i sin neutrale tilstand.
* Dens elektroniske konfiguration er:1S² 2S² 2p⁶ 3S² 3P⁶ 4S² 3D¹⁰ 4P⁵
2. Dannelse af bromidionen (Br⁻)
* Brom får en elektron for at opnå en stabil oktet (8 elektroner) i sin yderste skal.
* Den tilføjede elektron går ind i 4P -underskalet.
3. Elektronisk konfiguration af bromidion (BR⁻)
* Den elektroniske konfiguration af Br⁻ bliver:1S² 2S² 2P⁶ 3S² 3P⁶ 4S² 3D¹⁰ 4P⁶
4. Antal elektroner i den anden skal
* Den anden skal består af 2'erne og 2p underskaller.
* Bromidionen har 8 elektroner I den anden skal (2S² 2p⁶).
Derfor er der 8 elektroner i den anden skal af bromidionen (br⁻).
 Varme artikler
Varme artikler
-
 Kunstig tunge kan skelne mellem whiskyKredit:University of Glasgow Forskere afslørede tirsdag, at de er kommet med en kunstig tunge, der kan skelne subtile forskelle mellem whisky. Eksperter ved University of Glasgow har bygget miniat
Kunstig tunge kan skelne mellem whiskyKredit:University of Glasgow Forskere afslørede tirsdag, at de er kommet med en kunstig tunge, der kan skelne subtile forskelle mellem whisky. Eksperter ved University of Glasgow har bygget miniat -
 Kvantefysik og origami for det ultimative komme godt-kortMetal nanopartikel koncept kunst. Kredit:Prof. Eden Morales-Narváez, CIO Mexico Papirbaserede diagnostiske tests er billige, praktisk og biologisk nedbrydelig. Imidlertid, deres anvendelse er begr
Kvantefysik og origami for det ultimative komme godt-kortMetal nanopartikel koncept kunst. Kredit:Prof. Eden Morales-Narváez, CIO Mexico Papirbaserede diagnostiske tests er billige, praktisk og biologisk nedbrydelig. Imidlertid, deres anvendelse er begr -
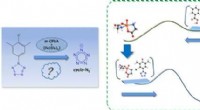 Forskere optrævler syntetisk mekanisme for arylpentazol og substituenteffekthttps://doi.org/10.1021/acs.jpclett.9b03762 Copyright © 2020 American Chemical Society For nylig, et forskerhold ledet af prof. Liu Jianyong og prof. Han Keli fra Dalian Institute of Chemical Phys
Forskere optrævler syntetisk mekanisme for arylpentazol og substituenteffekthttps://doi.org/10.1021/acs.jpclett.9b03762 Copyright © 2020 American Chemical Society For nylig, et forskerhold ledet af prof. Liu Jianyong og prof. Han Keli fra Dalian Institute of Chemical Phys -
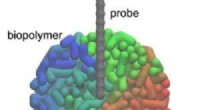 Simulering af 3D-AFM-billeder for systemer, der ikke er i ligevægtKredit:Kanazawa University Forskere ved Kanazawa University rapporterer i Journal of Physical Chemistry Letters hvordan man simulerer 3D atomic force mikroskopi billeder af ude af ligevægt systemer
Simulering af 3D-AFM-billeder for systemer, der ikke er i ligevægtKredit:Kanazawa University Forskere ved Kanazawa University rapporterer i Journal of Physical Chemistry Letters hvordan man simulerer 3D atomic force mikroskopi billeder af ude af ligevægt systemer
- Hvad er det samme mellem menneskeskabte og naturressourcer?
- Risiko i forsyningskæder er forskellig efter branche, ny rapport finder
- Genbrug af polypropylen fra tæppeaffald
- Hvordan CITES virker, og 5 arter at holde øje med
- Hvad var det sidste rumfartøj, der blev sendt ud i rummet?
- Ikke-giftig teknologi udvinder mere guld fra malm


