Hvilke trin bruges til at konvertere en empirisk formel til en molekylær formel?
1. Bestem den empiriske formel
* Dette findes normalt i problemet, eller du skal muligvis beregne dem fra eksperimentelle data (som procentkomposition).
2. Beregn den empiriske formelmasse
* Tilføj atommasserne af alle atomer i den empiriske formel.
3. Bestem molekylmassen
* Dette gives normalt i problemet. Hvis ikke, skal du muligvis finde det ved hjælp af teknikker som massespektrometri.
4. Find hele nummerforholdet
* Opdel molekylmassen med den empiriske formelmasse. Dette giver dig et helt tal eller et tal meget tæt på et helt nummer.
5. Multiplicer den empiriske formel med hele nummerforholdet
* Multiplicer underskrifterne i den empiriske formel med det hele nummer, du lige har beregnet. Dette giver dig den molekylære formel.
Eksempel:
Lad os sige, at vi har en empirisk formel af CH2O og en molekylær masse på 180 g/mol.
1. Empirisk formel: CH2O
2. Empirisk formelmasse: 12.01 (c) + 2 (1,01) (h) + 16,00 (o) =30,03 g/mol
3. molekylær masse: 180 g/mol
4. hele nummerforhold: 180 g/mol/30,03 g/mol ≈ 6
5. molekylær formel: (CH2O) * 6 = C6H12O6 (glukose)
Nøglepunkter
* Empirisk formel: Det enkleste forhold mellem hele nummeret for atomer i en forbindelse.
* molekylær formel: Det faktiske antal atomer i hvert element i et molekyle.
* molekylær masse: Massen af et molekyle af forbindelsen.
* Hele-nummerforholdet fortæller dig, hvor mange gange den empiriske formel gentages i molekylformlen.
Fortæl mig, hvis du gerne vil prøve et eksempel sammen!
 Varme artikler
Varme artikler
-
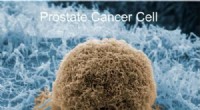 Billig detektor er som velcro til kræftcellerKredit:American Chemical Society Forskere har udviklet en ny type sensor, der fungerer som velcro for prostatacancerceller, klæbe dem på et modificeret matglas, som dem, der bruges i naturfag, så
Billig detektor er som velcro til kræftcellerKredit:American Chemical Society Forskere har udviklet en ny type sensor, der fungerer som velcro for prostatacancerceller, klæbe dem på et modificeret matglas, som dem, der bruges i naturfag, så -
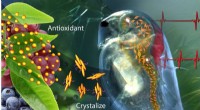 Smart antioxidantholdig polymer reagerer på kroppens kemi, miljøEt nyt lægemiddelleveringssystem, der indeholder krystalliseret catechin - en antioxidant, der findes i grøn te og frugt - kan mærke problemer og reagere ved at frigive antioxidant for at genoprette e
Smart antioxidantholdig polymer reagerer på kroppens kemi, miljøEt nyt lægemiddelleveringssystem, der indeholder krystalliseret catechin - en antioxidant, der findes i grøn te og frugt - kan mærke problemer og reagere ved at frigive antioxidant for at genoprette e -
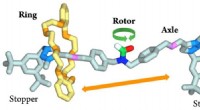 Mekanik af det uendeligt små:NanoGear, mod et molekylært gearNanoGear-molekylet tilhører klassen af rotaxaner og består af tre komponenter:en ring, der kan glide langs en aksel, der bærer en rotor installeret i dets centrum. Ved 65 °C, ringen pendler fra den
Mekanik af det uendeligt små:NanoGear, mod et molekylært gearNanoGear-molekylet tilhører klassen af rotaxaner og består af tre komponenter:en ring, der kan glide langs en aksel, der bærer en rotor installeret i dets centrum. Ved 65 °C, ringen pendler fra den -
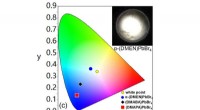 Ændring af den interne struktur af 2-D hybrid perovskit materialer får dem til at udsende hvidt ly…Farvekoordinatkortet illustrerer lysets farver, der udsendes af forskellige hybridperovskitter (med varierende grader af intern strukturel forvrængning) i forhold til ren hvid (svarende til den gule c
Ændring af den interne struktur af 2-D hybrid perovskit materialer får dem til at udsende hvidt ly…Farvekoordinatkortet illustrerer lysets farver, der udsendes af forskellige hybridperovskitter (med varierende grader af intern strukturel forvrængning) i forhold til ren hvid (svarende til den gule c


