Når en opløst stof opløses i vand, gør frysepunktet hvad?
Her er hvorfor:
* Forstyrrelse af vandstruktur: Når en opløst stof opløses i vand, forstyrrer den de normale hydrogenbindingsinteraktioner mellem vandmolekyler. Disse interaktioner er afgørende for at danne den ordnede krystallinske isstruktur.
* sænkning af damptrykket: Tilstedeværelsen af et opløst stof sænker opløsningens damptryk sammenlignet med rent vand. Dette betyder, at opløsningen skal afkøles til en lavere temperatur for at nå det samme damptryk som den faste fase (ICE), hvilket fører til et lavere frysepunkt.
Kolligative egenskaber
Frysningspunktdepression er en colligativ egenskab , hvilket betyder, at det kun afhænger af koncentrationen af opløste partikler, ikke af den specifikke type opløst stof. Jo større koncentration af opløste partikler er, jo større er frysepunktdepressionen.
Eksempel:
Tilsætning af salt til vand sænker frysepunktet. Derfor bruger vi salt på veje om vinteren til at smelte is.
Sidste artikelHvordan opfører vandmolekyler sig?
Næste artikelHvordan kan du skelne en forbindelse fra blandingen?
 Varme artikler
Varme artikler
-
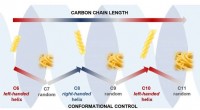 Kulstofkæder antager fusilli- eller spaghetti-former, hvis de har ulige eller lige talBilledet viser, hvordan konformationen (formen) af vores carbonkæder veksler mellem ordnede og kaotiske strukturer, da carbonkæden veksler mellem at have lige og ulige antal atomer. Kredit:University
Kulstofkæder antager fusilli- eller spaghetti-former, hvis de har ulige eller lige talBilledet viser, hvordan konformationen (formen) af vores carbonkæder veksler mellem ordnede og kaotiske strukturer, da carbonkæden veksler mellem at have lige og ulige antal atomer. Kredit:University -
 Hvor grøn er din vandtætte jakke?Kredit:University of Leeds I lyset af uforudsigelige vejrforhold, vandtætte jakker er blevet nøgleelementer i mange menneskers garderober. Men ny forskning fra University of Leeds tyder på, at br
Hvor grøn er din vandtætte jakke?Kredit:University of Leeds I lyset af uforudsigelige vejrforhold, vandtætte jakker er blevet nøgleelementer i mange menneskers garderober. Men ny forskning fra University of Leeds tyder på, at br -
 Turende strukturer i et menneskeskabt interfaceReaktionsdiffusionsprocessen drev dannelsen af den komplicerede uorganiske Turing -struktur. Kredit:ZHANG Xiaolong I 1952, Alan Turing, far til datalogi og kunstig intelligens, foreslået, at vis
Turende strukturer i et menneskeskabt interfaceReaktionsdiffusionsprocessen drev dannelsen af den komplicerede uorganiske Turing -struktur. Kredit:ZHANG Xiaolong I 1952, Alan Turing, far til datalogi og kunstig intelligens, foreslået, at vis -
 Forskere udvikler katalysatorer til at omdanne ethanol til kemikalier og brændstoffer af høj værd…Forskere ved Pacific Northwest National Laboratory har udviklet en ny katalysator, der omdanner ethanol til C5+ ketoner, der kan tjene som byggesten til alt fra opløsningsmidler til jetbrændstof. I et
Forskere udvikler katalysatorer til at omdanne ethanol til kemikalier og brændstoffer af høj værd…Forskere ved Pacific Northwest National Laboratory har udviklet en ny katalysator, der omdanner ethanol til C5+ ketoner, der kan tjene som byggesten til alt fra opløsningsmidler til jetbrændstof. I et
- Sender du e-mail under Zoom-møder? Ny forskning viser fordelene ved multikommunikation på arbejdsp…
- Vejafgiften stiger i vulkanen i Guatemala, efterhånden som flere lig er kommet sig
- Hvad sker der med Solens energi, når den når jordens overflade?
- Er nogen landet på månen siden Neil Armstrong?
- Du ender stadig med ingenting:Virkeligheden af at leve i arbejde fattigdom afsløret
- Hvor hurtigt fordamper vandet?


