Hvordan opfører vandmolekyler sig?
1. Polaritet:
* bøjet form: Molekylet har en bøjet form på grund af de to ensomme par elektroner på iltatomet, hvilket får molekylet til at være polært.
* ujævn gebyrfordeling: Oxygenatomet er mere elektronegativt, hvilket betyder, at det tiltrækker elektroner stærkere end hydrogenatomerne. Dette skaber en delvis negativ ladning på iltsiden og delvis positive ladninger på brintsiderne.
2. Hydrogenbinding:
* Stærke attraktioner: Den delvise positive ladning på hydrogenatomet i et vandmolekyle tiltrækkes af den delvise negative ladning på iltatomet i et andet vandmolekyle. Dette danner en stærk intermolekylær binding kaldet en hydrogenbinding.
* Høj samhørighed &adhæsion: Hydrogenbindinger er ansvarlige for vandets høje samhørighed (tiltrækning mellem vandmolekyler) og vedhæftning (tiltrækning til andre overflader). Dette forklarer Water's evne til at rejse op ad smalle rør (kapillærhandling) og dets overfladespænding.
3. Dynamisk og fleksibel:
* Konstant bevægelse: Vandmolekyler bevæger sig konstant, roterer og vibrerer, bryder og reformerer brintbindinger. Denne dynamik forklarer Water's evne til at opløse en lang række stoffer og dens relativt høje varmekapacitet (evne til at absorbere varme uden betydelig temperaturændring).
4. Stater med stof:
* flydende tilstand: Hydrogenbindingerne i vand er stærke nok til at holde molekylerne tæt sammen, hvilket skaber en flydende tilstand.
* solid tilstand (is): Når vand fryser, bliver molekylerne mindre mobile og danner en stiv, krystallinsk struktur med en lavere densitet end flydende vand. Dette er grunden til, at is flyder.
* gasformig tilstand (damp): Ved høje temperaturer har molekylerne nok energi til at bryde brintbindingerne og undslippe i gasfasen.
5. Egenskaber påvirket af adfærd:
* Højt kogepunkt: Vand har et højt kogepunkt på grund af de stærke brintbindinger mellem molekyler.
* universelt opløsningsmiddel: Vands polaritet og hydrogenbinding giver den mulighed for at opløse mange polære og ioniske stoffer.
* Høj varmekapacitet: Vand kan absorbere en masse varme, før dens temperatur ændrer sig markant, hvilket gør det til en vigtig temperaturregulator.
* overfladespænding: Vandets overfladespænding er forårsaget af de stærke sammenhængende kræfter mellem molekyler, hvilket gør det opfører sig som et tyndt elastisk ark.
Sammenfattende resulterer opførslen af vandmolekyler, drevet af deres polaritet og hydrogenbinding, i unikke egenskaber, der er afgørende for livet på jorden. De tillader, at vand er et fremragende opløsningsmiddel, regulerer temperaturer og understøtter livet gennem dets bemærkelsesværdige egenskaber.
Sidste artikelFast homogent stof med naturlig geometrisk form?
Næste artikelNår en opløst stof opløses i vand, gør frysepunktet hvad?
 Varme artikler
Varme artikler
-
 Forskere udvikler en måde at bedre forudsige korrosion fra råolieKredit:iStockphoto.com Ved hjælp af røntgenteknikker, forskere udvikler et analyseværktøj, der mere præcist kan forudsige, hvordan svovlforbindelser i et parti råolie kan tære udstyr - et vigtigt
Forskere udvikler en måde at bedre forudsige korrosion fra råolieKredit:iStockphoto.com Ved hjælp af røntgenteknikker, forskere udvikler et analyseværktøj, der mere præcist kan forudsige, hvordan svovlforbindelser i et parti råolie kan tære udstyr - et vigtigt -
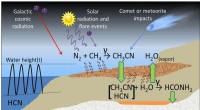 Opstod vandbaseret liv uden vand?Foreslået proces til formamidsyntese nær radioaktive mineralaflejringer på Jordens overflade. Kredit:Adam et al. Udgivet i Videnskabelige rapporter . Når man forsøger at forstå oprindelsen af
Opstod vandbaseret liv uden vand?Foreslået proces til formamidsyntese nær radioaktive mineralaflejringer på Jordens overflade. Kredit:Adam et al. Udgivet i Videnskabelige rapporter . Når man forsøger at forstå oprindelsen af -
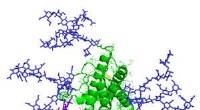 Kroppen er afhængig af tusinder af sukker -proteinkomplekser for at forblive sundEn model af erythropoetin, et glycoprotein involveret i produktionen af røde blodlegemer. Glykaner er angivet med lilla. Kredit:Mark Wormald, Oxford Glycobiology Institute Over to uger i 2004, S
Kroppen er afhængig af tusinder af sukker -proteinkomplekser for at forblive sundEn model af erythropoetin, et glycoprotein involveret i produktionen af røde blodlegemer. Glykaner er angivet med lilla. Kredit:Mark Wormald, Oxford Glycobiology Institute Over to uger i 2004, S -
 Nye beviser viser, at de første byggesten i livet på Jorden kan have været mere rodet end tidlige…Szostak mener, at de tidligste celler er udviklet på land i damme eller bassiner, potentielt i vulkansk aktive regioner. Ultraviolet lys, lynnedslag, og vulkanudbrud kunne alle have været med til at u
Nye beviser viser, at de første byggesten i livet på Jorden kan have været mere rodet end tidlige…Szostak mener, at de tidligste celler er udviklet på land i damme eller bassiner, potentielt i vulkansk aktive regioner. Ultraviolet lys, lynnedslag, og vulkanudbrud kunne alle have været med til at u
- Tropical Storm Irwins østlige side bygger på satellitbilleder
- På fem år nåede dette australske astrofysiklaboratorium 50 % kvinder. Her er hvordan de gjorde de…
- Ny hypotese foreslået om, hvorfor nogle frø er hårde
- Opdeler din celle i hele livet?
- Hvor gamle tror forskere, at solsystemet er?
- Hvordan Hollywood Screen Siren Hedy Lamarr hjalp Pioneer WiFi og GPS


