Hvorfor har alle elementer i en gruppe lignende fysiske og kemiske egenskaber?
Her er hvorfor:
* Valenselektroner: Dette er elektronerne i den yderste skal af et atom. Det er dem, der er involveret i kemisk binding og reaktioner.
* Lignende reaktivitet: Elementer i den samme gruppe har det samme antal valenselektroner, hvilket betyder, at de har en tendens til at vinde, miste eller dele elektroner på en lignende måde. Dette resulterer i lignende reaktivitet og kemisk opførsel.
* Lignende binding: Elementer i den samme gruppe danner lignende typer bindinger (f.eks. Ionisk, kovalent). For eksempel har alle elementer i gruppe 1 (alkalimetaller) en tendens til at miste en elektron og form +1 -ioner.
* Lignende fysiske egenskaber: Selvom det ikke altid er så direkte som kemiske egenskaber, kan antallet af valenselektroner også påvirke fysiske egenskaber som smeltepunkt, kogepunkt og densitet.
Eksempel:
* gruppe 1 (alkalimetaller): Lithium (Li), natrium (NA), kalium (K), Rubidium (RB), Cesium (CS) og Francium (FR) har alle en valenselektron. Dette fører til lignende reaktivitet (reagerer let med vand) og fysiske egenskaber (bløde, sølvfarvede metaller med lave smeltepunkter).
Kortfattet:
Ligheden i antallet af valenselektroner blandt elementer i en gruppe fører til lignende kemisk binding, reaktivitet og følgelig lignende fysiske og kemiske egenskaber.
 Varme artikler
Varme artikler
-
 En måde at øge strukturel stabilitet i anstrengte halogenidperovskitteren, Optiske billeder af de voksende epitaksiale α-FAPbI3 tynde film. Den høje gennemsigtighed af substraterne og de glatte overflader af de tynde film demonstrerer deres høje kvalitet. Målestænger, 4
En måde at øge strukturel stabilitet i anstrengte halogenidperovskitteren, Optiske billeder af de voksende epitaksiale α-FAPbI3 tynde film. Den høje gennemsigtighed af substraterne og de glatte overflader af de tynde film demonstrerer deres høje kvalitet. Målestænger, 4 -
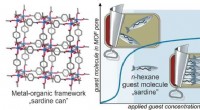 Gæstejustering og defektdannelse under porefyldning i metal-organiske rammefilmDen metalorganiske ramme danner et stillads med nanometerstore porer, som holder molekyler (til venstre). Så længe n-hexangas-molekyler tilsættes til porerne under tryk, justeres molekylerne i en sard
Gæstejustering og defektdannelse under porefyldning i metal-organiske rammefilmDen metalorganiske ramme danner et stillads med nanometerstore porer, som holder molekyler (til venstre). Så længe n-hexangas-molekyler tilsættes til porerne under tryk, justeres molekylerne i en sard -
 Vigtige trin til transformation af giftige molekyler i luft ved lave temperaturerBiludstødningsluftforurening i byer. Novosibirsk, vinter 2021. Kredit:S. Dukhovnikov Luftforurening fra brændstofforbrænding er et af de største miljøproblemer, især i bymiljøer. I tæt befolkede b
Vigtige trin til transformation af giftige molekyler i luft ved lave temperaturerBiludstødningsluftforurening i byer. Novosibirsk, vinter 2021. Kredit:S. Dukhovnikov Luftforurening fra brændstofforbrænding er et af de største miljøproblemer, især i bymiljøer. I tæt befolkede b -
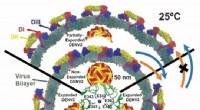 Dengue -infektion korrelerer med dynamik snarere end morfologierKredit:National University of Singapore NUS -biofysikere har opdaget nye konformationsændringer og strukturelle dynamikker af denguevirus under deres overførsel til menneskelige værter. Dengue-in
Dengue -infektion korrelerer med dynamik snarere end morfologierKredit:National University of Singapore NUS -biofysikere har opdaget nye konformationsændringer og strukturelle dynamikker af denguevirus under deres overførsel til menneskelige værter. Dengue-in
- Hvilket mikroskopisk dyr lever i støv?
- Hvad gør en god brugshund? Hundens 'egnethedstest' kan give fingerpeg
- Klart og effektivt lys uden sjældne metaller
- Menneskelige samfund udvikler sig ad lignende veje
- Forskere identificerer potentielle vaccinemål, der i stigende grad vedrører bakteriestamme
- Hvad skifter vand fra gasser til væske?


