Hvornår anvendes kvanterne molære entalpier af fusion og entalpi -dampning?
Molær entalpi af fusion (ΔHFUS)
* Beregning af varme, der kræves til smeltning:
* Denne entalpi -værdi fortæller dig, hvor meget energi der kræves for at smelte en mol af et stof på dets smeltepunkt. Du kan bruge det til at beregne den samlede varme, der er nødvendig for at smelte en bestemt masse af stoffet.
* Formula:Q =NΔHFUS, hvor Q er varmen, N er antallet af mol, og ΔHfus er den molære entalpi af fusion.
* faseændringsberegninger:
* Når et stof skifter fra fast til væske (smelte), er den absorberede energi relateret til fusionens entalpi.
Molær entalpi af fordampning (ΔHVAP)
* Beregning af varme, der kræves til kogning:
* Denne entalpi -værdi fortæller dig, hvor meget energi der kræves for at fordampe en mol af et stof på dets kogepunkt. Du kan bruge det til at beregne den samlede varme, der er nødvendig for at fordampe en bestemt masse af stoffet.
* Formel:Q =NΔHVAP, hvor Q er varmen, N er antallet af mol, og ΔHVAP er den molære entalpi af fordampning.
* faseændringsberegninger:
* Når et stof skifter fra væske til gas (kogning), er den absorberede energi relateret til fordampningens entalpi.
Andre applikationer
* termokemi: Disse entalpier er afgørende for beregning af enthalpi -ændringer (ΔH) under forskellige kemiske reaktioner, der involverer faseændringer.
* Bestemmelse af intermolekylære kræfter: Størrelsen af entalpien af fusion og fordampning kan give information om styrken af intermolekylære kræfter, der er til stede i et stof. Stærkere kræfter fører til højere entalpi -værdier.
* Materialsvidenskab: At forstå disse entalpier er vigtigt for at designe og analysere materialer med specifikke smeltnings- og kogepunkter.
Sammenfattende er molære entalpier af fusion og fordampning grundlæggende termodynamiske mængder, der bruges til at forstå og forudsige energiændringer forbundet med faseovergange, og de har anvendelser inden for forskellige videnskabelige og ingeniørfelter.
 Varme artikler
Varme artikler
-
 Selvkomprimerende beton bliver mere bæredygtig takket være at bruge granitresterEn UCO-undersøgelse beviser muligheden for at erstatte op til 40% af konventionelle tilslag af selvkomprimerende mørtel med granitslam, dermed reducere byggesektorens miljøbelastning. Kredit:Universit
Selvkomprimerende beton bliver mere bæredygtig takket være at bruge granitresterEn UCO-undersøgelse beviser muligheden for at erstatte op til 40% af konventionelle tilslag af selvkomprimerende mørtel med granitslam, dermed reducere byggesektorens miljøbelastning. Kredit:Universit -
 Den kemiske udvikling af DNA og RNA på den tidlige JordDe grundlæggende bestanddele af de tidligste RNA-molekyler kan være dannet i et geotermisk miljø, sådan set her i Yellowstone National Park i Wyoming. Foto:picture alliance / Mint Images RNA var s
Den kemiske udvikling af DNA og RNA på den tidlige JordDe grundlæggende bestanddele af de tidligste RNA-molekyler kan være dannet i et geotermisk miljø, sådan set her i Yellowstone National Park i Wyoming. Foto:picture alliance / Mint Images RNA var s -
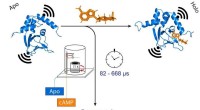 Forskere undersøger strukturelle ændringer i snapfrosne proteinernår cAMP (orange) binder. Dette ændrer også afstanden mellem de to molekylære magneter knyttet til kanalen (sort). Kredit:(c) Tobias Hett / Universität Bonn und Forschungszentrum caesar Forskere v
Forskere undersøger strukturelle ændringer i snapfrosne proteinernår cAMP (orange) binder. Dette ændrer også afstanden mellem de to molekylære magneter knyttet til kanalen (sort). Kredit:(c) Tobias Hett / Universität Bonn und Forschungszentrum caesar Forskere v -
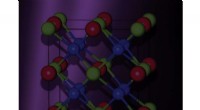 Fremstilling af nye katalysatorer af unikke metalliske legeringerTsai og hans kolleger tror på materialeinformatik, som bruger big data til at opdage nye materialer, kunne være særligt relevant for opdagelsen af nye katalysatorer fra Heusler-legeringer på grund a
Fremstilling af nye katalysatorer af unikke metalliske legeringerTsai og hans kolleger tror på materialeinformatik, som bruger big data til at opdage nye materialer, kunne være særligt relevant for opdagelsen af nye katalysatorer fra Heusler-legeringer på grund a


