Forskere undersøger strukturelle ændringer i snapfrosne proteiner
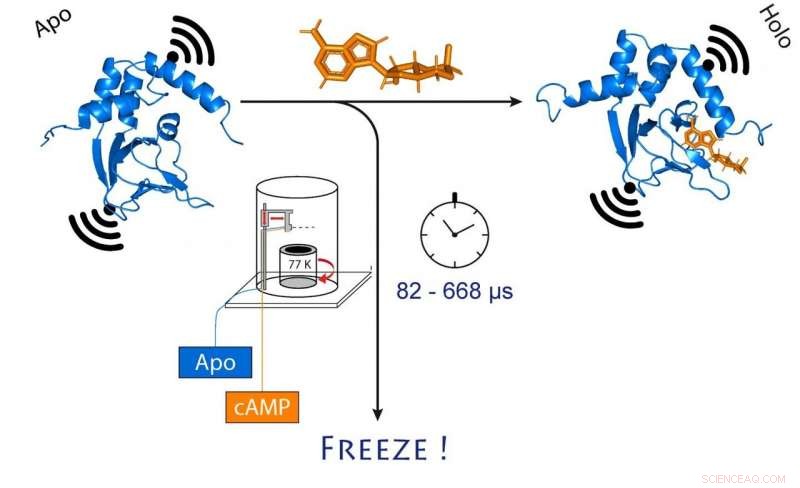
når cAMP (orange) binder. Dette ændrer også afstanden mellem de to molekylære magneter knyttet til kanalen (sort). Kredit:(c) Tobias Hett / Universität Bonn und Forschungszentrum caesar
Forskere ved universitetet i Bonn og forskningscentret caesar er lykkedes med ultrahurtig frysning af proteiner efter et præcist defineret tidsrum. De var i stand til at følge strukturelle ændringer på mikrosekunders tidsskala og med sub-nanometer præcision. På grund af sin høje rumlige og tidsmæssige opløsning, metoden gør det muligt at spore hurtige strukturelle ændringer i enzymer og nukleinsyrer. Resultaterne er offentliggjort i Journal of the American Chemical Society.
Hvis du vil vide, hvordan den rumlige struktur af et biomolekyle ser ud, du har et formidabelt arsenal af værktøjer til din rådighed. De mest populære er elektronmikroskopi og røntgendiffraktion, som kan afsløre selv de mindste detaljer af et protein. Imidlertid, en væsentlig begrænsning ved disse metoder er, at de normalt leverer statiske billeder, som ofte er utilstrækkelige til at forstå biomolekylære processer i præcise mekanistiske termer. Derfor, et langsigtet mål for mange forskningsgrupper verden over har været at spore bevægelserne i et makromolekyle, såsom et protein, over tid, mens det udfører sit arbejde, ligesom i en film. Forskergrupperne ledet af Prof. Dr. Olav Schiemann fra Institut for Fysisk og Teoretisk Kemi ved Bonn Universitet og Prof. Dr. Benjamin Kaupp fra Forskningscentret Cæsar i Max Planck Society er nu kommet et skridt tættere på at opnå dette mål.
De valgte en ionkanal til deres undersøgelse. Dette er et protein, der danner minimale porer i cellemembranen, som er permeable for ladede partikler kaldet ioner. "Denne kanal er normalt lukket, Schiemann forklarer. "Den åbner kun, når en cellulær messenger, kaldet cAMP, binder sig til det. Vi ville gerne vide, hvordan præcis denne proces fungerer."
Minimagneter til at måle afstande
For at gøre det, forskerne blandede først kanalproteinet og cAMP og frøs derefter hurtigt opløsningen ned. I frossen tilstand, proteinstrukturen kan nu analyseres. For deres metode til at fungere, de havde fastgjort molekylære elektromagneter på to punkter i kanalen. Afstanden mellem disse magneter kan bestemmes med en præcision på nogle få Ångstrøm (ti milliardtedele af en millimeter) ved hjælp af en sofistikeret metode kaldet PELDOR, som fungerer som en molekylær lineal. I de seneste år, metoden blev markant forfinet og forbedret i Schiemanns gruppe.
"Imidlertid, dette giver os kun et statisk billede af cAMP-binding til ionkanalen, ", siger Schiemann. "Vi gentog derfor fryseprocessen på forskellige tidspunkter efter at have blandet de to molekyler. Dette gjorde det muligt at rekonstruere bevægelserne i proteinet efter cAMP-binding - ligesom en film, som også består af en sekvens af billeder."
I centrum af denne procedure er en sofistikeret metode, der gør det muligt at blande prøver og fryse dem meget hurtigt på et præcist tidspunkt. Teknikken, kaldet "microsecond freeze hyperquenching" (forkortet MHQ), blev oprindeligt udviklet ved Delft University, men gik senere ud af brug. Det blev genopdaget og beslutsomt forfinet af Kaupps gruppe.
"I MHQ-enheden, cAMP-molekylet og ionkanalen blandes ved ultrahurtig hastighed, Købp forklarer. "Derefter skydes blandingen som en hårtynd strøm på en meget kold metalcylinder ved -190 °C, som drejer 7, 000 gange i minuttet. Det var særligt udfordrende at overføre de frosne prøver til PELDOR-målingen fra metalpladen til tynde glasrør, og at holde dem frosne imens. Det var vi nødt til at designe og bygge specialværktøjer til."
Dybfrysning på 82 milliontedele af et sekund
Hele blandings- og fryseprocessen tager kun 82 mikrosekunder (et mikrosekund er lig med en milliontedel af et sekund). "Dette giver os mulighed for at visualisere meget hurtige ændringer i den rumlige struktur af proteiner, " forklarer Tobias Hett, en af de to ph.d.-studerende, der bidrog væsentligt til succesen. Fordelen ved metoden er dens kombination af høj rumlig og tidsmæssig opløsning. "Dette repræsenterer et stort skridt fremad i at studere dynamiske processer i biomolekyler, " understreger Kaupp.
Forskerne planlægger nu at bruge deres metode til at se nærmere på andre biomolekyler. De håber at få ny indsigt, for eksempel i funktionen af enzymer og nukleinsyrer. Betydningen af sådanne indsigter illustreres bedst af den seneste verdensomspændende stigning i strukturel forskning om SARS-coronavirus-2:Virussens såkaldte spikeprotein undergår også en strukturel ændring, når menneskeceller inficeres. Tydeliggørelse af denne mekanisme vil give værdifuld information om, hvordan man målretter infektionsmekanismen med nye lægemidler.
Forberedelse af prøverne, den eksperimentelle udførelse, og analysen af dataene er meget kompleks. Resultaterne af undersøgelsen afspejler derfor også et vellykket videnskabeligt samarbejde med forskere ledet af prof. Dr. Helmut Grubmüller fra Max Planck Instituttet for Biofysisk Kemi i Göttingen og prof. Dr. Heinz-Jürgen Steinhoff fra Universitetet i Osnabrück.
 Varme artikler
Varme artikler
-
 Katalysatorfremskridt kan føre til økonomiske brændselscellerSkematisk illustration af enkeltatomskatalysator forankret på porøst kulstof. Kredit:WSU Forskere ved Washington State University har udviklet en ny måde at lave billige, enkeltatoms katalysatorer
Katalysatorfremskridt kan føre til økonomiske brændselscellerSkematisk illustration af enkeltatomskatalysator forankret på porøst kulstof. Kredit:WSU Forskere ved Washington State University har udviklet en ny måde at lave billige, enkeltatoms katalysatorer -
 Ultrabright røntgenstråler afslører den molekylære struktur af membraner, der bruges til afsaltn…Qinyi Fu, Francisco J. Medellin-Rodriguez, Nisha Verma, og Benjamin Ocko (fra venstre mod højre) forbereder sig på at montere de membranprøver, der efterligner de membraner, der bruges i omvendt osmos
Ultrabright røntgenstråler afslører den molekylære struktur af membraner, der bruges til afsaltn…Qinyi Fu, Francisco J. Medellin-Rodriguez, Nisha Verma, og Benjamin Ocko (fra venstre mod højre) forbereder sig på at montere de membranprøver, der efterligner de membraner, der bruges i omvendt osmos -
 En ny ligand forlænger halveringstiden for peptider fra minutter til dageEt bicyklisk peptid (hvidt) bundet til serumalbumin (rødt) gennem den nyudviklede ligand (grøn), flyder i blodbanen. Kredit:C. Heinis/EPFL EPFL-forskere har udviklet et ligandmolekyle, der forbind
En ny ligand forlænger halveringstiden for peptider fra minutter til dageEt bicyklisk peptid (hvidt) bundet til serumalbumin (rødt) gennem den nyudviklede ligand (grøn), flyder i blodbanen. Kredit:C. Heinis/EPFL EPFL-forskere har udviklet et ligandmolekyle, der forbind -
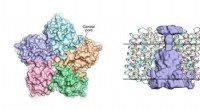 Forskere afslører strukturen af virale rhodopsinerTil venstre:et billede af OLPVRII -pentameren fra den cytoplasmatiske side. Den centrale pore er kontureret af en rød cirkel. Til højre:set fra siden af pentameren. Den centrale pore er farvet lyseb
Forskere afslører strukturen af virale rhodopsinerTil venstre:et billede af OLPVRII -pentameren fra den cytoplasmatiske side. Den centrale pore er kontureret af en rød cirkel. Til højre:set fra siden af pentameren. Den centrale pore er farvet lyseb
- Sådan beregnes koncentration ved hjælp af Absorbance
- Ultrashort lysimpulser til hurtige lysbølgecomputere
- NASA finder et nåleøje i den tropiske cyklon Funani
- Frugtfluer og elektroner:Forskere bruger fysik til at forudsige mængdenes adfærd
- Sluk et lys, redde et liv, siger ny undersøgelse
- Har en planet brug for kontinenter for at understøtte livet?


