Hvad går ind i en reaktion, og hvad kommer der ud af reaktion?
hvad der går i (reaktanter):
* Stoffer: Dette er udgangsmaterialerne for en kemisk reaktion. Tænk på dem som ingredienserne i en opskrift.
* Energi: Kemiske reaktioner kan kræve energi for at komme i gang. Dette kaldes aktiveringsenergi.
Hvad kommer ud (produkter):
* Nye stoffer: Reaktionen omarrangerer reaktanternes atomer til at danne nye molekyler, hvilket skaber helt forskellige stoffer med forskellige egenskaber.
* Energi: Kemiske reaktioner frigiver enten energi (eksotermisk) eller absorberer energi (endotermisk).
En simpel analogi:
Forestil dig at bage en kage:
* reaktanter: Mel, sukker, æg, smør osv. (Ingredienserne)
* Energi: Varmen fra ovnen (aktiveringsenergi)
* Produkter: En lækker kage (et nyt stof)
* Energi: Kagen frigiver muligvis noget varme, da den bager (eksoterm reaktion)
Nøglepunkter:
* bevarelse af masse: I en kemisk reaktion svarer den samlede masse af reaktanterne den samlede masse af produkterne. Atomer oprettes ikke eller ødelægges, bare omarrangeres.
* Kemiske ligninger: Dette er en kortfattet måde at repræsentere kemiske reaktioner på. De viser reaktanterne på venstre side og produkterne på højre side, adskilt af en pil. For eksempel:
* 2 H₂ + O₂ → 2 H₂O (brint og ilt reagerer på dannelse af vand)
Eksempler:
* brændende træ: Træ (reaktant) + ilt (reaktant) + varme (aktiveringsenergi) → aske (produkt) + kuldioxid (produkt) + varme (frigivet)
* Fotosyntese: Kuldioxid (reaktant) + vand (reaktant) + lysenergi (aktiveringsenergi) → glukose (produkt) + ilt (produkt)
Fortæl mig, hvis du har flere spørgsmål om kemiske reaktioner!
 Varme artikler
Varme artikler
-
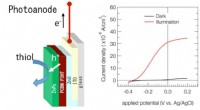 Miljøvenlige elektrokemiske katalysatorer, der bruger solceller til at høste energi fra solenStrukturen af den foreslåede enhed, viser, hvordan de genererede huller (h+) bruges til at lette thioloxidation. Den målte strøm stiger dramatisk under belysning og anvendelse af et lille potentiale
Miljøvenlige elektrokemiske katalysatorer, der bruger solceller til at høste energi fra solenStrukturen af den foreslåede enhed, viser, hvordan de genererede huller (h+) bruges til at lette thioloxidation. Den målte strøm stiger dramatisk under belysning og anvendelse af et lille potentiale -
 Kemiske jobsøgende står over for hårde udsigter under pandemienKredit:CC0 Public Domain Selvom det er over et årti, recessionen i 2008 og dens virkninger stadig hænger over kemi -virksomheden. Og nu med COVID-19-pandemien, der lukker laboratorier og universit
Kemiske jobsøgende står over for hårde udsigter under pandemienKredit:CC0 Public Domain Selvom det er over et årti, recessionen i 2008 og dens virkninger stadig hænger over kemi -virksomheden. Og nu med COVID-19-pandemien, der lukker laboratorier og universit -
 Elektricitetsdrevne undersøiske reaktioner kan have været vigtige for livets opståenForskningsgruppen har foreslået en effektiv mekanisme til at udnytte den kemiske energi, der genereres af varme hydrotermiske væsker, der strømmer ud af hydrotermiske ventilationsåbninger på Jordens t
Elektricitetsdrevne undersøiske reaktioner kan have været vigtige for livets opståenForskningsgruppen har foreslået en effektiv mekanisme til at udnytte den kemiske energi, der genereres af varme hydrotermiske væsker, der strømmer ud af hydrotermiske ventilationsåbninger på Jordens t -
 SwRI-udviklet mobilsystem til at ødelægge farlige kemiske krigsførende stoffer på stedetSwRI er ved at udvikle en mobil behandlingsenhed (til venstre) til at ødelægge kemiske midler. Efter at agenterne er blevet ødelagt, Udstødningsgasser ledes gennem et jordbaseret fluid bed og scrubber
SwRI-udviklet mobilsystem til at ødelægge farlige kemiske krigsførende stoffer på stedetSwRI er ved at udvikle en mobil behandlingsenhed (til venstre) til at ødelægge kemiske midler. Efter at agenterne er blevet ødelagt, Udstødningsgasser ledes gennem et jordbaseret fluid bed og scrubber
- En kosmisk tango:Denne fjerne planets mærkelige bane peger på en voldelig og kaotisk fortid
- Undersøgelse af virkningen af ansøgers ryge- og dampvaner i jobsamtaler
- Keeping Kermit:Nye spor til at beskytte frøer mod dødelig Bd-svamp
- Rekord solskin under første COVID-19 lockdown stort set forårsaget af usædvanligt vejr
- Tre typer stenarter, der formes, når Lava Cools
- Hvad er den grundlæggende struktur i en neuron?


