Hvad gør en isotop forskellig fra almindeligt atom?
* Antal neutroner: Isotoper af det samme element har det samme antal protoner (som definerer elementet), men de kan have forskellige antal neutroner.
* atommasse: Forskellen i neutroner påvirker atommassen. Isotoper af det samme element har lidt forskellige atommasser.
Lad os nedbryde det med et eksempel:
* carbon-12 er den mest almindelige form for kulstof. Det har 6 protoner og 6 neutroner.
* carbon-14 er en isotop af kulstof. Det har stadig 6 protoner, men det har 8 neutroner.
Både carbon-12 og carbon-14 er kulstof, fordi de begge har 6 protoner. Men deres forskellige antal neutroner får dem til isotoper.
nøgle ting at huske:
* Isotoper er variationer af det samme element.
* Forskellen ligger i antallet af neutroner, der påvirker atommassen.
* Isotoper har de samme kemiske egenskaber som det "almindelige" atom for elementet, fordi antallet af elektroner (som bestemmer kemisk opførsel) forbliver det samme.
Fortæl mig, hvis du gerne vil have flere detaljer eller have et andet spørgsmål!
 Varme artikler
Varme artikler
-
 Support vokser til bæredygtig metode til fremstilling af kompositfiberpladerForskere fra Purdue University har udviklet en lavere pris, bæredygtig og grønnere metode til fremstilling af sammensatte plader - en metode, der allerede oplever voksende støtte fra store brancheaktø
Support vokser til bæredygtig metode til fremstilling af kompositfiberpladerForskere fra Purdue University har udviklet en lavere pris, bæredygtig og grønnere metode til fremstilling af sammensatte plader - en metode, der allerede oplever voksende støtte fra store brancheaktø -
 De udvidede muligheder for biobaserede polymererKredit:Institut for Kemisk Forskning i Catalonien At finde innovative og bæredygtige løsninger til vores materialebehov er et af kernemålene for grøn kemi. De utallige plastik, der omslutter vores
De udvidede muligheder for biobaserede polymererKredit:Institut for Kemisk Forskning i Catalonien At finde innovative og bæredygtige løsninger til vores materialebehov er et af kernemålene for grøn kemi. De utallige plastik, der omslutter vores -
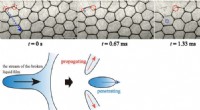 To distinkte fysiske mekanismer identificeret for, hvordan simple skum kollapserFilmen ses at trække sig tilbage i omgivende film, mens en dråbe frigives, som trænger ind i andre film og forårsager yderligere kollaps. Kredit:Rei Kurita Forskere fra Tokyo Metropolitan Universi
To distinkte fysiske mekanismer identificeret for, hvordan simple skum kollapserFilmen ses at trække sig tilbage i omgivende film, mens en dråbe frigives, som trænger ind i andre film og forårsager yderligere kollaps. Kredit:Rei Kurita Forskere fra Tokyo Metropolitan Universi -
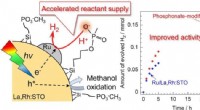 Øget fotokatalyse for hydrogenudvikling:Reaktantforsyning gennem phosphonatgrupperSkematisk illustration af alkylsilanphosphonatmodifikationen af en Ru/La, Rh:STO fotokatalysator for at fremskynde reaktantforsyningen. Kredit:© 2020 Yosuke Kageshima, Shinshu universitet Forskn
Øget fotokatalyse for hydrogenudvikling:Reaktantforsyning gennem phosphonatgrupperSkematisk illustration af alkylsilanphosphonatmodifikationen af en Ru/La, Rh:STO fotokatalysator for at fremskynde reaktantforsyningen. Kredit:© 2020 Yosuke Kageshima, Shinshu universitet Forskn
- Teknik til fremstilling af keramiske film til OPV mellemlag
- Undersøgelse viser, hvordan forbrugerne stoler på prisen for at bestemme kvaliteten af produkter…
- Hvilken astronom fandt, at planeter ikke bevæger sig i cirkler?
- Hvad er en type afkomproduktion?
- Praktisk placering af en nær-tærskel proton-emitterende resonans i bor-11
- Polymerer forhindrer potentielt farlig tåge under tandlægebesøg


