Hvilke grupper er stabile alkalimetaller eller alkanie jordhalogener ædle gasser?
* alkalimetaller (gruppe 1): Alkali -metaller er meget reaktive På grund af kun en valenselektron. Denne ensomme elektron går let tabt, hvilket gør dem til fremragende reduktionsmidler (de donerer let elektroner). De betragtes ikke som stabile i deres elementære form.
* alkaliske jordmetaller (gruppe 2): Alkaliske jordmetaller er også reaktive , men lidt mindre end alkalimetaller. De har to valenselektroner og danner let +2 ioner. De betragtes ikke som stabile i deres elementære form.
* halogener (gruppe 17): Halogener er meget reaktive ikke -metaller. De har syv valenselektroner og har en tendens til at få en elektron til dannelse af en -1 -ion og bliver stabile halogenider. De er ikke stabile i deres elementære form.
* ædle gasser (gruppe 18): Ædle gasser er ekstremt stabile . De har en fuld ydre skal af elektroner (otte elektroner, bortset fra helium med to), hvilket gør dem meget ureaktive. De findes som stabile monatomiske gasser.
Sammendrag:
* stabil: Ædle gasser (gruppe 18)
* ustabil: Alkali -metaller (gruppe 1), alkaliske jordmetaller (gruppe 2), halogener (gruppe 17)
Sidste artikelHvorfor korroderer metaller i forskellige hastigheder?
Næste artikelHvad gør en isotop forskellig fra almindeligt atom?
 Varme artikler
Varme artikler
-
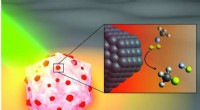 Team afslører katalysator, der kan bryde problematiske C-F-bindingerEn kunstners illustration af den lysaktiverede antenne-reaktor-katalysator Rice University-ingeniører designet til at bryde kulstof-fluor-bindinger i fluorcarboner. Aluminiumsdelen af partiklen (hvi
Team afslører katalysator, der kan bryde problematiske C-F-bindingerEn kunstners illustration af den lysaktiverede antenne-reaktor-katalysator Rice University-ingeniører designet til at bryde kulstof-fluor-bindinger i fluorcarboner. Aluminiumsdelen af partiklen (hvi -
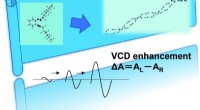 En ny horisont for vibrationel cirkulær dikroismespektroskopiTidstrin VCD målte overvågning in situ af udviklingen af chiralitetsforstærkning fra mikroskopiske til supramolekylære skalaer. Kredit:Royal Society of Chemistry Vibrationel cirkulær dichroism (
En ny horisont for vibrationel cirkulær dikroismespektroskopiTidstrin VCD målte overvågning in situ af udviklingen af chiralitetsforstærkning fra mikroskopiske til supramolekylære skalaer. Kredit:Royal Society of Chemistry Vibrationel cirkulær dichroism ( -
 Sporing af bortskaffelse af proteiner kan føre til forbedrede behandlingerHiroaki Kiyokawa, MD, Ph.d., professor i farmakologi og patologi, var co-senior forfatter på undersøgelser publiceret i Naturkommunikation og Videnskabens fremskridt . Kredit:Northwestern Universi
Sporing af bortskaffelse af proteiner kan føre til forbedrede behandlingerHiroaki Kiyokawa, MD, Ph.d., professor i farmakologi og patologi, var co-senior forfatter på undersøgelser publiceret i Naturkommunikation og Videnskabens fremskridt . Kredit:Northwestern Universi -
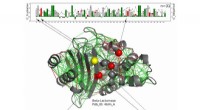 Arbejdsproteiner gør god brug af frustrationI denne strukturelle model for et beta-lactamase-protein, Katalytiske rester er vist som kugler med dem, der konsekvent er stærkt frustrerede langs hele beta-lactamase-familien vist med rødt, og dem,
Arbejdsproteiner gør god brug af frustrationI denne strukturelle model for et beta-lactamase-protein, Katalytiske rester er vist som kugler med dem, der konsekvent er stærkt frustrerede langs hele beta-lactamase-familien vist med rødt, og dem,
- Hvad hedder den billowy sky med lav højde?
- Gamle artefakter beslaglagt fra Hobby Lobby vendte tilbage til Irak
- Global Gaia-kampagne afslører hemmeligheder bag stjernepar
- Hvad sker der, når noget i en fødekæde uddød?
- Hvad beskriver en gas på mikroskala?
- Facebook har brug for regulering - her er grunden til, at det skal gøres ved hjælp af algoritmer


