Sporing af bortskaffelse af proteiner kan føre til forbedrede behandlinger

Hiroaki Kiyokawa, MD, Ph.d., professor i farmakologi og patologi, var co-senior forfatter på undersøgelser publiceret i Naturkommunikation og Videnskabens fremskridt . Kredit:Northwestern University
Northwestern Medicine-forskere udviklede en teknik til at katalogisere, hvordan celler bortskaffer unødvendige proteiner, en proces, der har betydning for kræft og autismespektrumsygdomme, ifølge resultater offentliggjort i Naturkommunikation .
Defekter i ubiquitination, eller hvordan celler bortskaffer unødvendige proteiner, været involveret i en række sygdomme, men forskere har tidligere manglet en pålidelig metode til at spore de enzymer, der er involveret i denne bortskaffelsesproces, ifølge Hiroaki Kiyokawa, MD, Ph.D., professor i farmakologi og co-senior forfatter på undersøgelsen.
For at bekæmpe dette, et samarbejdende team ledet af Kiyokawa og Jun Yin, Ph.D., lektor i kemi ved Georgia State University, udviklet ortogonal ubiquitinoverførsel, en metode til at spore, hvilke enzymer der udløser bortskaffelse af hvilke proteiner. Denne teknik kan give forskere en bedre forståelse af mekanismerne for sygdom, der opstår ved unormal ubiquitinering, forhåbentlig fører til forbedret terapi, sagde Kiyokawa.
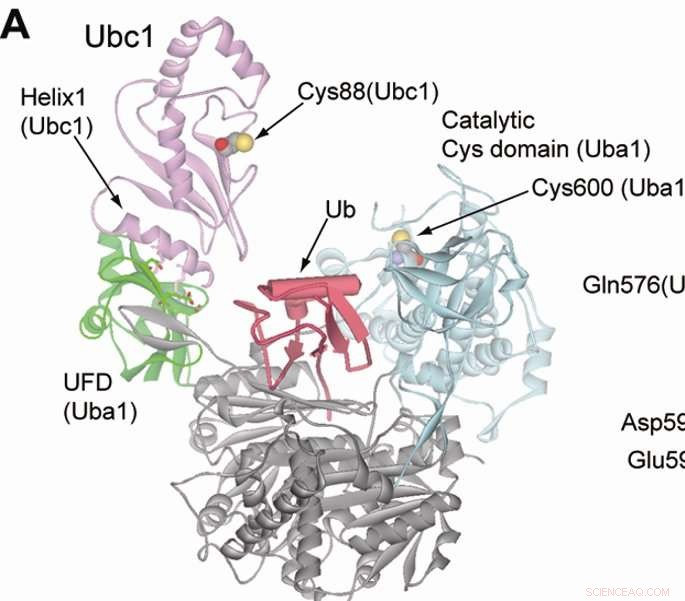
Ubiquitination markerer proteiner til ødelæggelse og lettes af tre klasser af enzymer; E1, E2 og E3 enzymer. Ubiquitin er bundet til de tre enzymer i rækkefølge, men E1 og E2 enzymer er simple primer enzymer, så pattedyrsceller har kun et begrænset antal E1- og E2 -sorter. På den anden side, der er hundredvis af E3 -enzymer, tyder på, at hver E3 har sit eget unikke proteinmål.
"Forholdet mellem E3-enzymer og målproteinet er som en lås og en nøgle, " sagde Kiyokawa, også professor i patologi og medlem af Robert. H. Lurie Comprehensive Cancer Center ved Northwestern University.
Mangfoldigheden af målproteiner og svage interaktioner betyder, at det kan være udfordrende klart at identificere, hvilket E3-enzym, der mærker hvilket protein. Imidlertid, ortogonal ubiquitinoverførsel (OUT) er en ny løsning på problemet, ifølge Kiyokawa.
Ind ud, forskere konstruerede en kunstig ubiquitin-vej, der efterligner det oprindelige system, men kun reagerer på muteret ubiquitin, som har et særligt tag, der gør det muligt for forskere at identificere det protein, det i sidste ende målretter mod i slutningen af cyklussen.
"Der er to veje i de samme celler, "Sagde Kiyokawa." Originalen ligner en motorvej, og den konstruerede vej er en omvej. "
Illustration, der viser ubiquitin, der bevæger sig fra et E1-enzym til et E2-enzym. Kredit:Northwestern University
I den aktuelle undersøgelse, efterforskerne konstruerede en kunstig vej til et E3 -enzym kaldet E6AP, og introducerede det muterede ubiquitin og pathways i celler. Efter en proteomics-skærm, forskerne var i stand til at identificere de specifikke proteinmål for E6AP.
"Denne undersøgelse er kun et udstillingsvindue af teknologien, men vi tror, vi kan anvende dette på mange af de 600 E3-proteiner uden for meget besvær, " sagde Kiyokawa. "En hel del E3-enzymer er kendt for at være overudtrykt eller muteret i neuronale sygdomme, så der er en stor pulje af forskningsmuligheder."
Imidlertid, Især E6AP har vist sig at målrette tumorsuppressorproteiner, når de aktiveres forkert af det humane papillomavirus, bidrager til den øgede kræftrisiko for inficerede patienter. Ud over, genlocuset, der koder for E6AP, er kendt for at være muteret i Angelman syndrom, en autismespektrumforstyrrelse.
"Vi ved stadig ikke, hvorfor E6AP skal muteres for at vise symptomer på Angelman syndrom, men undersøgelser af specifikke mål kan lære os mere om de patofysiologiske mekanismer ved autistisk sygdom, "Sagde Kiyokawa.
Yderligere undersøgelse af specifikke mål er allerede i gang - Kiyokawa og kolleger har for nylig offentliggjort en anden undersøgelse, der involverer OUT, denne gang i Videnskabens fremskridt .
De fandt et andet E3-enzym, CHIP, var involveret i nedbrydning af CDK4, et enzym, der spiller en nøglerolle i celleproliferation.
"Det ser ud til at være en mekanisme, der kan stoppe cellecyklussen under stress, " sagde Kiyokawa. "Hvis denne regulering er brudt, organismen kan være mere modtagelig for kræft."
Endnu, det er ikke nok blot at identificere disse mål for ubiquitinering, ifølge Kiyokawa.
"Vi er nødt til at lære, hvorfor disse nyligt definerede mål er under regulering af E3-enzymer, hvis vi ønsker at finde nye terapeutiske mål, "sagde han." Først da kan vi udvikle medicin eller behandlinger. "
 Varme artikler
Varme artikler
-
 Et nyt kig på farvedisplaysMagnus Jonsson, lektor, og Shangzhi Chen, postdoc, ved Laboratory of Organic Electronics ved Linköpings Universitet. Kredit:Thor Balkhed Forskere ved Linköpings Universitet har udviklet en metode,
Et nyt kig på farvedisplaysMagnus Jonsson, lektor, og Shangzhi Chen, postdoc, ved Laboratory of Organic Electronics ved Linköpings Universitet. Kredit:Thor Balkhed Forskere ved Linköpings Universitet har udviklet en metode, -
 Hvordan bestemmer man, om en reaktion er endoterm eller eksoterm i et kalorimetrisk eksperiment?En kalorimeter er en enhed, som omhyggeligt måler temperaturen på et isoleret system både før og efter en reaktion finder sted. Temperaturændringen fortæller os, om termisk energi blev absorberet elle
Hvordan bestemmer man, om en reaktion er endoterm eller eksoterm i et kalorimetrisk eksperiment?En kalorimeter er en enhed, som omhyggeligt måler temperaturen på et isoleret system både før og efter en reaktion finder sted. Temperaturændringen fortæller os, om termisk energi blev absorberet elle -
 Hjælper mikrochipindustrien med at gå (meget lavt) med strømmenProcesingeniør Richard Kasica fra NISTs Center for Nanoscale Science and Technology holder en wafer af den type, der typisk produceres i det plasmaforstærkede kemiske dampaflejringskammer i midten. Kr
Hjælper mikrochipindustrien med at gå (meget lavt) med strømmenProcesingeniør Richard Kasica fra NISTs Center for Nanoscale Science and Technology holder en wafer af den type, der typisk produceres i det plasmaforstærkede kemiske dampaflejringskammer i midten. Kr -
 Perovskite solceller:Mulige aspekter af høj effektivitet afdækketTegningen illustrerer vekselvirkningen af den organiske methylammoniumkation (CH3NH3+) med de omgivende iodidioner. Skiftet af iodidatomerne ud af det fælles plan med bly forårsager brud på inversio
Perovskite solceller:Mulige aspekter af høj effektivitet afdækketTegningen illustrerer vekselvirkningen af den organiske methylammoniumkation (CH3NH3+) med de omgivende iodidioner. Skiftet af iodidatomerne ud af det fælles plan med bly forårsager brud på inversio
- Hvordan narcissistiske ledere inficerer deres organisations kulturer
- Dens regnende nåle:Narkotikakrise skaber forureningstrussel
- Sådan lærer du diskret Math
- Singapore kan bruge droner til at levere medicin, for sikkerheden
- AI-værktøj karakteriserer en sanggenre og giver indsigt i perceptionsmusik
- Forskere udvikler en ny proces, der gør affald til kosttilskud


