Forskere rapporterer den første 3D-struktur af DHHC-enzymer
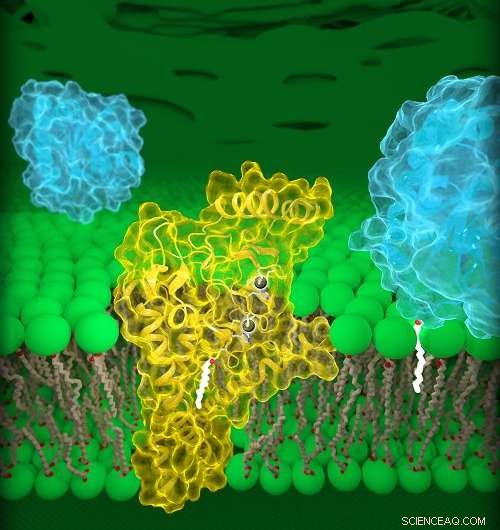
Human DHHC20 (gul) er indlejret i Golgi-membranen (grøn), et rum placeret inde i celler. DHHC20 knytter en fedtsyrekæde (hvid) til et målprotein (blå, forgrund), som forankrer proteinet til Golgi-membranen. Kredit:Jeremy Swan, NICHD/NIH
Den første tredimensionelle struktur af DHHC-proteiner - enzymer involveret i mange cellulære processer, inklusive cancer - forklarer, hvordan de fungerer og kan tilbyde en plan for udformning af terapeutiske lægemidler. Forskere har foreslået at blokere DHHC-aktivitet for at øge effektiviteten af førstelinjebehandlinger mod almindelige former for lunge- og brystkræft. Imidlertid, der er i øjeblikket ingen licenserede lægemidler, der er målrettet mod specifikke DHHC -enzymer. Studiet, ledet af forskere ved Eunice Kennedy Shriver National Institute of Child Health and Human Development (NICHD), optræder i seneste nummer af Videnskab .
DHHC enzymer, også kaldet palmitoyltransferaser, modificere andre proteiner ved at vedhæfte dem en kæde af lipider, eller fedtsyrer, af varierende længde. Denne ændring, kaldet palmitoylering, kan ændre mange egenskaber ved et målprotein, såsom dens struktur, funktion og placering i en celle. Forskere vurderer, at næsten 1, 000 humane proteiner gennemgår palmitoylering, herunder epidermale vækstfaktorreceptorer (EGFR'er). En velkendt EGFR er HER2, som er overaktiveret ved aggressive former for brystkræft. EGFR'er kan også overaktiveres i tyktarmskræft, og ikke-småcellet lungekræft, den mest almindelige form for lungekræft.
Den aktuelle undersøgelse beskriver strukturerne af et humant DHHC-enzym, DHHC20, og zebrafiskversionen af et andet DHHC-enzym, DHHC15. Vigtigere, DHHC20 er det enzym, der palmitoylerer EGFR. Tidligere undersøgelser har vist, at blokering af DHHC20 gør kræftceller mere sårbare over for eksisterende FDA-godkendte behandlinger, der retter sig mod EGFR. Derfor, forståelse af strukturen af DHHC20 kan være vigtig for behandling af EGFR-drevne kræftformer.
"Mutationer i DHHC -enzymer er forbundet med forskellige kræftformer og neurologiske lidelser, " ifølge Anirban Banerjee, Ph.D., undersøgelsens hovedforfatter og leder af NICHDs enhed for strukturel og kemisk biologi af membranproteiner. "Vores undersøgelse giver et udgangspunkt for at udvikle DHHC20-hæmmere, der kan hjælpe med behandling af almindelige kræftformer og fremme området for proteinpalmitoylering."
Dr. Banerjee og kolleger identificerede en strukturel komponent, et hulrum, af DHHC20, der påvirker længden af dets lipidkæde. Mutationer, der ændrede den relative størrelse af dette hulrum, fik DHHC20 til at bruge kortere eller længere lipidkæder, hvilket formentlig ændrer virkningerne af palmitoylering på et målprotein. Forskerne foreslår, at strukturen på dette websted forklarer, hvorfor forskellige DHHC -enzymer bruger visse lipidkæder til at ændre funktionerne af andre proteiner. Det giver også indsigt i, hvordan flere enzymer arbejder sammen i sundheds- og sygdomstilstande.
Sidste artikelSporing af bortskaffelse af proteiner kan føre til forbedrede behandlinger
Næste artikelBerusende lysfølsomme
 Varme artikler
Varme artikler
-
 Afblanding ved hjælp af lasere for at lave nye krystallerForskere har formået at adskille to væsker i en blanding ved hjælp af en laser, som de hævder vil føre til nye måder at manipulere stof på og skabe krystaller til industrien. I et papir offentliggjor
Afblanding ved hjælp af lasere for at lave nye krystallerForskere har formået at adskille to væsker i en blanding ved hjælp af en laser, som de hævder vil føre til nye måder at manipulere stof på og skabe krystaller til industrien. I et papir offentliggjor -
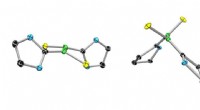 Generering af en stabil biradicalEn konventionel bor-bor dobbeltbinding (venstre) og dens ekstremt stabile biradiske slægtning. Kredit:Dr. Rian Dewhurst Bor har en række anvendelser, fra vaskeblegemiddel til varmebestandigt glas
Generering af en stabil biradicalEn konventionel bor-bor dobbeltbinding (venstre) og dens ekstremt stabile biradiske slægtning. Kredit:Dr. Rian Dewhurst Bor har en række anvendelser, fra vaskeblegemiddel til varmebestandigt glas -
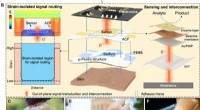 En bærbar, fritstående elektrokemisk sensorsystemFESS design begrundelse, implementering, og ansøgning. (A) skematisk af biomarkørinformationsleveringsvejen aktiveret af FESS, illustrerer prøveudtagning, sansning, og routing af epidermalt hentet bio
En bærbar, fritstående elektrokemisk sensorsystemFESS design begrundelse, implementering, og ansøgning. (A) skematisk af biomarkørinformationsleveringsvejen aktiveret af FESS, illustrerer prøveudtagning, sansning, og routing af epidermalt hentet bio -
 Forskning viser fingeraftryk på vejKredit:University of Abertay Dundee Ny forskning ved Abertay University har opdaget, at gerningsstedets fingeraftryk kan flytte sig, efter at de er blevet deponeret. Projektet ledet af Abertays r
Forskning viser fingeraftryk på vejKredit:University of Abertay Dundee Ny forskning ved Abertay University har opdaget, at gerningsstedets fingeraftryk kan flytte sig, efter at de er blevet deponeret. Projektet ledet af Abertays r
- Hvordan bliver jeg astronaut?
- Hvad er de letteste elementer?
- Seismisk coda bruges til at lokalisere og definere skader fra eksplosioner
- Transparent elektronik fra grafenbaserede elektroder (m/ video)
- Typer af edderkopper: Sort med hvide dots
- Et netværk af krystaller til langdistance kvantekommunikation


