Arbejdsproteiner gør god brug af frustration
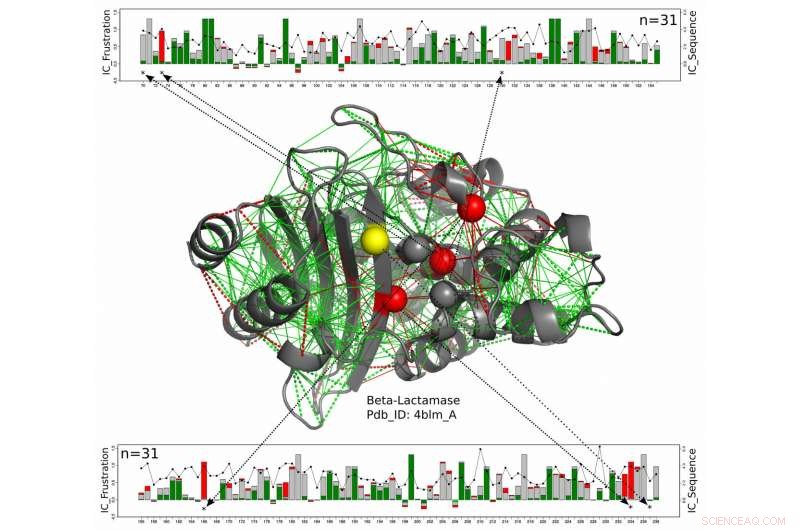
I denne strukturelle model for et beta-lactamase-protein, Katalytiske rester er vist som kugler med dem, der konsekvent er stærkt frustrerede langs hele beta-lactamase-familien vist med rødt, og dem, for hvilke den frustrerede tilstand ikke er konserveret i gult. Det nye arbejde af forskere ved Rice University, Universitetet i Buenos Aires og European Molecular Biology Laboratory foreslår disse enzymer, som skal forblive udsat for at reagere med deres mål, få en vis beskyttelse mod de noget frustrerede aminosyrer omkring dem. De grønne linjer repræsenterer minimal frustration, de røde linjer repræsenterer høj frustration. De lineære diagrammer øverst og nederst viser positionerne af de relevante aminosyrer på proteinkæden og et mål for bevarelsen af energi over hele beta-lactamase-proteinfamilien. Kredit:Maria Feiberger/University of Buenos Aires
Proteiner folder efter et script skrevet i mønsteret af deres aminosyrer. Men for at fungere korrekt, nogle dele skal ad-lib.
De aktive steder af enzymer, proteiner, der fremskynder og styrer biokemiske reaktioner, gøre livet muligt. At gøre dette, deres instruktioner skal være i en vis konflikt med proteinets overordnede strukturplan, ifølge forskere ved Rice University, universitetet i Buenos Aires og European Molecular Biology Laboratory i Heidelberg, Tyskland.
Ifølge forskerne, evolutionen har udvalgt dele af enzymer som værende vigtige nok til at få lov til energisk at afvige fra instruktionerne, der fører til en foldetragt, som guider proteinerne ind i deres funktionelle lavenergitilstande. Ved at undersøge stort set alle kendte enzymer, forskerne bekræftede også mistanken om, at yderligere niveauer af mere svagt frustrerede interaktioner omgiver og understøtter selve de katalytiske steder.
Teorien beskrevet i Proceedings of the National Academy of Sciences udvider det accepterede princip om minimal frustration, der forklarer, hvorfor proteiner gnidningsløst kan udvikle sig fra de lineære sekvenser, der oprindeligt er kodet i deres DNA, til deres funktion. tredimensionelle kugleformer. Dette princip anerkender det faktum, at frustration ofte bliver uløst, når den resterende energiske konflikt på en eller anden måde tjener proteinets funktion.
Ifølge Rice's Peter Wolynes, der forkyndte princippet i matematisk form for mere end 20 år siden, energilandskaberne af proteiner med katalytiske dele er værd at analysere ekstra, i betragtning af den betydning evolutionen har tillagt dem.
"Et perfekt foldet molekyle, uanset hvor smuk som en skulptur, kan ikke gøre meget, " sagde han. "Du skal have et protein, der mens den for det meste er foldet, har stadig et par frustrerede hængsler, der er uforenelige med foldning, men er nødvendige for at tillade den bevægelse, der kræves til kemiske reaktioner."
Frustration på atomniveau er enkel at opleve:Bare skub de positive poler af to magneter sammen og mærk, hvordan de skubber tilbage. Ligesom magneter, aminosyrerne i et foldeprotein tiltrækker og frastøder hinanden, da de (for det meste) løser konflikter og til sidst kommer til at danne et stabilt arrangement af kontakter.
"Tilføj nu en tredje magnet, og du kan støde på frustration, som du ikke kan slippe af med, " sagde medforfatter Wolynes, som arbejdede med Buenos Aires-holdet ledet af den biologiske kemiker Diego Ferreiro, en tidligere postdoc i sin gruppe.
Den nye undersøgelse viser, at frustration blandt enzymets naboaminosyrer, som i situationen med den tredje magnet, virker for at hjælpe det frustrerede enzym med at stå fast. Det forbliver noget ustabilt, men har områder, der er tilgængelige til at binde med og modificere målmolekyler.
Klart, Wolynes sagde, evolution har prioriteter, der afløser æstetikken for at opnå en perfekt fold.
Forskerholdet undersøgte beregningsmæssigt hundredvis af kendte proteinstrukturer og opdagede, at hele familier af enzymer deler karakteristiske signaturer af frustration på det aktive sted, der strækker sig til det andet og tredje aminosyrelag, eller skaller, omkring enzymet.
"Det interessante, vi fandt, var, at frustration generelt strækker sig ud over den absolutte første skal, " sagde han. "Det betyder, at der er en akavet, men nødvendig subtilitet til de funktionelle begrænsninger, der kræver at få disse tre skaller rigtigt."
Wolynes bemærkede, at nobelpristageren Frances Arnold og andre, der studerer kunstig evolution i laboratoriet, har set tegn på udvidet frustration i deres bestræbelser på at modificere enzymer til nye reaktioner.
"Nogle gange ville de specifikt ændre det aktive sted for at katalysere forskellige kemiske reaktioner fra de naturlige, men fandt ud af, at aminosyrer fjernt fra det aktive sted også skulle ændres for at få enzymet til at fungere effektivt, " sagde han. "Det var ikke indlysende hvorfor, men modellerne viser, at ændringer i den anden og tredje skal forbedrer enzymernes katalytiske evne.
"Så vores resultater var ikke et komplet chok, men det er rart at se, at langvarig frustration er ret udbredt i naturen og er et fælles tema gennem alle de kendte enzymklasser, " han sagde.
 Varme artikler
Varme artikler
-
 Storstilet og bæredygtig 3D-print med det mest allestedsnærværende naturmateriale1,2 m, 5,2 kg turbinevinge fremstillet udelukkende af cellulose og chitosan, de mest allestedsnærværende biopolymerer på jorden og produceret i store mængder i næsten alle økosystemer. Begge ingredien
Storstilet og bæredygtig 3D-print med det mest allestedsnærværende naturmateriale1,2 m, 5,2 kg turbinevinge fremstillet udelukkende af cellulose og chitosan, de mest allestedsnærværende biopolymerer på jorden og produceret i store mængder i næsten alle økosystemer. Begge ingredien -
 Ny teknologi vil gøre det muligt at fremstille vigtige metaller mere effektivtVed at tilføje kombinationer af kulstof, brint, og iltatomer til stædige, svære at fordampe metaller som wolfram og platin, University of Minnesota Twin Cities forskere var i stand til at omdanne elem
Ny teknologi vil gøre det muligt at fremstille vigtige metaller mere effektivtVed at tilføje kombinationer af kulstof, brint, og iltatomer til stædige, svære at fordampe metaller som wolfram og platin, University of Minnesota Twin Cities forskere var i stand til at omdanne elem -
 Artificial Chemist 2.0:Quantum dot R&D på mindre end en timeDette farvehjul af kvanteprikker fremhæver nogle af de farver, der kan laves med Artificial Chemist 2.0. Kredit:Milad Abolhasani, NC State University En ny teknologi, kaldet Artificial Chemist 2.0
Artificial Chemist 2.0:Quantum dot R&D på mindre end en timeDette farvehjul af kvanteprikker fremhæver nogle af de farver, der kan laves med Artificial Chemist 2.0. Kredit:Milad Abolhasani, NC State University En ny teknologi, kaldet Artificial Chemist 2.0 -
 Opdagelsen af knock-on kemi åbner nye grænser inden for reaktionsdynamikEn kunstners fortolkning af den energibarriere, som et reagensfluoratom skal krydse, når det kolliderer med et fluormethylmolekyle på vej til at danne et produkt som følge af en kemisk reaktion. Forsk
Opdagelsen af knock-on kemi åbner nye grænser inden for reaktionsdynamikEn kunstners fortolkning af den energibarriere, som et reagensfluoratom skal krydse, når det kolliderer med et fluormethylmolekyle på vej til at danne et produkt som følge af en kemisk reaktion. Forsk
- Om spændingsreduktionsmodstand Formula
- Dekonstruktion af osmose giver indsigt til medicinsk og industriel brug
- Ny rapport fremhæver virkningen af sundhedsuligheder i hele Europa
- Studiet udfordrer ideen om, at elever med kognitive handicap ikke kan være i STEM
- Nanoimprinted hyperlens array:baner vejen for praktisk billedoptagelse i superopløsning
- Hedebølger længere, mere dødbringende selv i en 2C-verden


