Hvad er stoffer, der fjerner h fra en løsning?
Her er hvorfor:
* syrer Doner H+ -ioner (protoner) til en opløsning, hvilket øger koncentrationen af H+ -ioner.
* baser Accepter H+ -ioner fra en opløsning, hvilket reducerer koncentrationen af H+ -ioner.
Der er forskellige måder, baser kan fjerne H+ fra en løsning:
* hydroxidioner (OH-) Reager direkte med H+ -ioner for at danne vand:
* H + + OH- -> H2O
* Andre baser kan reagere med H+ for at danne en ny forbindelse, hvilket effektivt fjerner H+ fra opløsningen.
Eksempler på baser:
* natriumhydroxid (NaOH) - En stærk base, der let dissocierer i vand for at danne ohioner.
* ammoniak (NH3) - En svag base, der reagerer med vand til dannelse af ammonium (NH4+) ioner og ohonioner.
* calciumcarbonat (CACO3) - En solid base, der reagerer med syrer for at neutralisere dem.
Bemærk: Styrken af en base henviser til dens evne til at acceptere H+ -ioner. Stærke baser adskiller sig fuldstændigt i vand, mens svage baser kun delvist adskiller sig.
Sidste artikelHvad er vand i en løsning?
Næste artikelHvad er nikkel II -sulfat?
 Varme artikler
Varme artikler
-
 Når menneske og maskine er enige om iridiumoxidKredit:CC0 Public Domain Et menneskeligt forskerhold og en maskinlæringsalgoritme har fundet ud af, at vi er nødt til at genoverveje meget af det, vi ved om iridiumoxid. Iridiumoxid er en fremrag
Når menneske og maskine er enige om iridiumoxidKredit:CC0 Public Domain Et menneskeligt forskerhold og en maskinlæringsalgoritme har fundet ud af, at vi er nødt til at genoverveje meget af det, vi ved om iridiumoxid. Iridiumoxid er en fremrag -
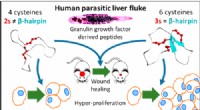 Et molekyle produceret af en thailandsk leverparasit kan være løsningen på de ikke-helende sårKredit:ACS Hver dag amputeres 12 australske diabetikere på grund af et sår, der ikke heler. Globalt set det er en hvert 30. sekund. Et molekyle produceret af en thailandsk leverparasit kan være l
Et molekyle produceret af en thailandsk leverparasit kan være løsningen på de ikke-helende sårKredit:ACS Hver dag amputeres 12 australske diabetikere på grund af et sår, der ikke heler. Globalt set det er en hvert 30. sekund. Et molekyle produceret af en thailandsk leverparasit kan være l -
 Molybdæn-belagt katalysator spalter vand til brintproduktion mere effektivtForskere har udviklet en ny molybdæn-belagt katalysator, der forhindrer en uønsket tilbagereaktion i visse kemiske systemer, der spalter vand til brint og oxygen. Kredit:Andy Freeberg/SLAC National Ac
Molybdæn-belagt katalysator spalter vand til brintproduktion mere effektivtForskere har udviklet en ny molybdæn-belagt katalysator, der forhindrer en uønsket tilbagereaktion i visse kemiske systemer, der spalter vand til brint og oxygen. Kredit:Andy Freeberg/SLAC National Ac -
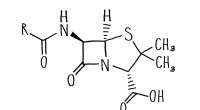 Den rettede evolution åbner døren til nye antibiotikaEn beta-lactam ring er kernen i mange antibiotika, inklusive penicillin. Kredit:Caltech I det igangværende våbenkapløb med mennesker og deres antibiotika på den ene side, og bakterier med deres ev
Den rettede evolution åbner døren til nye antibiotikaEn beta-lactam ring er kernen i mange antibiotika, inklusive penicillin. Kredit:Caltech I det igangværende våbenkapløb med mennesker og deres antibiotika på den ene side, og bakterier med deres ev
- Når elektronerne i et exciteret atom falder tilbage til lavere niveauer, er der emissionsenergi, de…
- Forestående død for papirkuponer?
- Forskere bygger en enzym-opdagende AI
- Klimaændringer gjorde sommertørke 20 gange mere sandsynlig
- Hvilke tre typer sediment måles for at opnå jordtekstur?
- Hvad betyder regnbuer?


