Er alle elektroner tilgængelige til limning?
Her er hvorfor:
* Valenselektroner: Elektroner i det yderste energiniveau af et atom, kaldet valenselektroner, er dem, der primært er involveret i kemisk binding. De er de "løse" elektroner, der kan deles eller overføres til danne bindinger.
* kerneelektroner: Elektroner i indre energiniveau er tættere bundet til kernen og deltager generelt ikke i binding. De er afskærmet mod interaktion med andre atomer.
Eksempel:
* carbon (c): Carbon har 6 elektroner (2 i den første skal, 4 i den anden). De 4 elektroner i den anden skal er valenselektroner og kan danne bindinger. De 2 elektroner i den første skal er kerneelektroner og er ikke involveret i binding.
Undtagelser:
* Overgangsmetaller: Overgangsmetaller har en mere kompleks elektronkonfiguration, og nogle af deres indre skalelektroner kan deltage i binding under visse omstændigheder.
Kortfattet: Kun valenselektroner af et atom er typisk tilgængelige til binding. Kerneelektroner forbliver tæt bundet til kernen og er ikke involveret i kemiske interaktioner.
 Varme artikler
Varme artikler
-
 Opdagelsen af livsforlængende vej hos orme viser en ny måde at studere aldring påCaenorhabditis elegans. Kredit:Wikipedia Et enzymblokerende molekyle kan forlænge levetiden for Caenorhabditis elegans rundorme med så meget som 45 procent, hovedsagelig ved at modulere en cannabi
Opdagelsen af livsforlængende vej hos orme viser en ny måde at studere aldring påCaenorhabditis elegans. Kredit:Wikipedia Et enzymblokerende molekyle kan forlænge levetiden for Caenorhabditis elegans rundorme med så meget som 45 procent, hovedsagelig ved at modulere en cannabi -
 Forskere præciserer aspektet af tyndfilm-fast-væske-interaktionerEn tynd film på overfladen af væske, som trækkes stramt ved grænsefladen. Da det forsigtigt skrælles væk, tegn på stress afsløres. Et team af fysikere præciserede for nylig spørgsmålet om, hvor mege
Forskere præciserer aspektet af tyndfilm-fast-væske-interaktionerEn tynd film på overfladen af væske, som trækkes stramt ved grænsefladen. Da det forsigtigt skrælles væk, tegn på stress afsløres. Et team af fysikere præciserede for nylig spørgsmålet om, hvor mege -
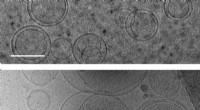 De første celler kan være opstået, fordi byggesten af proteiner stabiliserede membranerBilleder af membraner (cirkler) taget ved hjælp af transmissionselektronkryomikroskopi. Øverst:membraner i en opløsning, der ikke indeholder aminosyrer. Nederst:membraner i en opløsning indeholdende s
De første celler kan være opstået, fordi byggesten af proteiner stabiliserede membranerBilleder af membraner (cirkler) taget ved hjælp af transmissionselektronkryomikroskopi. Øverst:membraner i en opløsning, der ikke indeholder aminosyrer. Nederst:membraner i en opløsning indeholdende s -
 Video:Hvilken af disse svampe kan dræbe dig?Kredit:The American Chemical Society Der er titusindvis af svampearter derude, og nogle af dem kunne dræbe dig. I dag skal vi teste, hvor godt du kan adskille det helt sikre fra det farlige giftig
Video:Hvilken af disse svampe kan dræbe dig?Kredit:The American Chemical Society Der er titusindvis af svampearter derude, og nogle af dem kunne dræbe dig. I dag skal vi teste, hvor godt du kan adskille det helt sikre fra det farlige giftig
- Er en blomsterhomogen eller heterogen blanding?
- Hvilket produkt producerer mennesker under respiration, der bruges af planter?
- Hvad er de faktorer, der bestemmer mængden af friktion mellem to overflader?
- Hvad er flugthastigheden fra Moon for et månelandingsmodul, der sidder på overfladen?
- Curiosity siger farvel til Mars Vera Rubin Ridge
- Hvilket mineral har det højeste antal på Mohs -skalaen?


