Massen af blandingen isotoper til et element?
Sådan fungerer det:
* isotoper: Isotoper er atomer med det samme element, der har det samme antal protoner, men et andet antal neutroner. Dette betyder, at de har det samme atomnummer, men forskellige atommasser.
* Naturlig overflod: Hver isotop af et element findes i naturen med en bestemt procentdel kendt som dets naturlige overflod.
* gennemsnitlig atommasse: Den gennemsnitlige atommasse beregnes ved at tage hensyn til masserne af hver isotop og deres naturlige forekomst. Det er et vægtet gennemsnit, hvor vægten er den naturlige overflod.
Formel:
Gennemsnitlig atommasse =(masse af isotop 1 x overflod af isotop 1) + (masse af isotop 2 x overflod af isotop 2) + ...
Eksempel:
Chlor har to hovedisotoper:klor-35 (75,77% overflod) og chlor-37 (24,23% overflod).
Gennemsnitlig atommasse af klor =(35 amu x 0,7577) + (37 amu x 0,2423) =35,45 amu
Derfor er massen af blandingen af isotoper for et element repræsenteret af dets gennemsnitlige atommasse, som findes på den periodiske tabel.
Sidste artikelEr CO2 et kulhydratfedt eller olieproteinaminosyre ingen af disse?
Næste artikelEr alle elektroner tilgængelige til limning?
 Varme artikler
Varme artikler
-
 Nyligt syntetiseret svampemasse kan tænde en selvdestruerende knap for kræftKredit:Pixabay/CC0 Public Domain Kræftceller bruger en særlig teknik til at formere sig:De sletter deres programmerede død -gen gennem mutation, og tilsyneladende glemmer at dø, når deres levetid
Nyligt syntetiseret svampemasse kan tænde en selvdestruerende knap for kræftKredit:Pixabay/CC0 Public Domain Kræftceller bruger en særlig teknik til at formere sig:De sletter deres programmerede død -gen gennem mutation, og tilsyneladende glemmer at dø, når deres levetid -
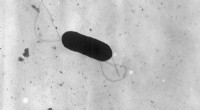 Stop listeria reproduktion i sine sporElektronmikrograf af en flagelleret Listeria monocytogenes -bakterie, Forstørret 41, 250X. Kredit:CDC/public domain Listeria -forureninger kan sende fødevareforarbejdningsfaciliteter i fuld krise
Stop listeria reproduktion i sine sporElektronmikrograf af en flagelleret Listeria monocytogenes -bakterie, Forstørret 41, 250X. Kredit:CDC/public domain Listeria -forureninger kan sende fødevareforarbejdningsfaciliteter i fuld krise -
 Tagging for metallegeringer genkender og mærker detaljerede mikroskopiske strukturerMetallurger er meget interesserede i at analysere materialemikrostrukturer, fordi de bestemmer deres egenskaber, ” siger Dmitry Bulgarevich fra Japans National Institute for Materials Science (NIMS).
Tagging for metallegeringer genkender og mærker detaljerede mikroskopiske strukturerMetallurger er meget interesserede i at analysere materialemikrostrukturer, fordi de bestemmer deres egenskaber, ” siger Dmitry Bulgarevich fra Japans National Institute for Materials Science (NIMS). -
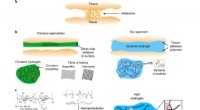 Forskere opdager, at gel reducerer arvæv efter operation hos dyren, Skematisk fremstilling af adhæsionsdannelse mellem to væv. b, Skematisk repræsentation af tidligere tilgange til at forhindre adhæsioner ved hjælp af solide adhæsionsbarrierer til fysisk at adskil
Forskere opdager, at gel reducerer arvæv efter operation hos dyren, Skematisk fremstilling af adhæsionsdannelse mellem to væv. b, Skematisk repræsentation af tidligere tilgange til at forhindre adhæsioner ved hjælp af solide adhæsionsbarrierer til fysisk at adskil
- Plast i oceanerne stiger, men beviser på skade er overraskende svage
- Van der Waals krydsspindventiler uden afstandsstykke
- Forskere identificerer vigtige videnshuller i bæredygtighedsforskning
- Udforskning af katalytiske reaktioner på nanoskala
- Hvor mange grader c er 67 f?
- Hvor mange miles er 12999 meter?


