Har jod et højere smelte- og kogepunkt end Florine?
* Intermolekylære kræfter: Jod (i₂) oplever stærkere intermolekylære kræfter end fluor (F₂). Specifikt udviser jod London-spredningskræfter, som er stærkere end dipol-dipol-interaktioner, der er til stede i fluor.
* atomstørrelse og polariserbarhed: Jodatomer er større end fluoratomer, hvilket gør dem mere polariserbare. Dette betyder, at elektronskyen i jod er lettere forvrænget, hvilket fører til stærkere London -spredningskræfter.
* molekylvægt: Jod har en højere molekylvægt end fluor, hvilket også bidrager til stærkere intermolekylære attraktioner.
Kortfattet: De stærkere intermolekylære kræfter i jod på grund af dens større størrelse, højere polariserbarhed og større molekylvægt resulterer i højere smeltnings- og kogepunkter sammenlignet med fluor.
 Varme artikler
Varme artikler
-
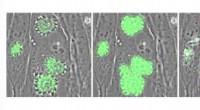 Parasitforskning varmer opIntracellulære Toxoplasma -parasitter, der udtrykker den genetisk kodede calciumindikator GCaMP. Parasitter blev behandlet med A23187, en forbindelse, der forårsager tilstrømning af calcium og stimule
Parasitforskning varmer opIntracellulære Toxoplasma -parasitter, der udtrykker den genetisk kodede calciumindikator GCaMP. Parasitter blev behandlet med A23187, en forbindelse, der forårsager tilstrømning af calcium og stimule -
 Ny udvikling inden for kontaktlinser til rød-grøn farveblindhed ved hjælp af simpelt farvestofKredit:University of Birmingham Forskere ved University of Birmingham har udviklet en kontaktlinse, der kan hjælpe mennesker med farveblindhed blot ved at bruge et billigt farvestof, ifølge forskn
Ny udvikling inden for kontaktlinser til rød-grøn farveblindhed ved hjælp af simpelt farvestofKredit:University of Birmingham Forskere ved University of Birmingham har udviklet en kontaktlinse, der kan hjælpe mennesker med farveblindhed blot ved at bruge et billigt farvestof, ifølge forskn -
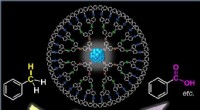 Metalliske nanopartikler lyser op en anden vej mod miljøvenlige katalysatorerHvert dendrimer-molekyle er vært for en metallisk partikel i subnano-størrelse, der muliggør oxidation af aromatiske kulbrinter, såsom toluen (venstre), at producere nyttige organiske forbindelser, så
Metalliske nanopartikler lyser op en anden vej mod miljøvenlige katalysatorerHvert dendrimer-molekyle er vært for en metallisk partikel i subnano-størrelse, der muliggør oxidation af aromatiske kulbrinter, såsom toluen (venstre), at producere nyttige organiske forbindelser, så -
 Platin-grafen brændselscellekatalysatorer viser overlegen stabilitet i forhold til bulk platinSeung Soon Jang, en lektor, Faisal Alamgir, en lektor, og Ji Il Choi, en postdoc forsker, alt i Georgia Techs School of Materials Science and Engineering, undersøge et stykke platin-grafen katalysator
Platin-grafen brændselscellekatalysatorer viser overlegen stabilitet i forhold til bulk platinSeung Soon Jang, en lektor, Faisal Alamgir, en lektor, og Ji Il Choi, en postdoc forsker, alt i Georgia Techs School of Materials Science and Engineering, undersøge et stykke platin-grafen katalysator
- Klimaændringer kan øge risudbyttet
- Hvordan elektricitet ændrer liv:et rwandisk casestudie
- Udnyttelse af kraften fra elektricitetsproducerende bakterier til programmerbare biohybrider
- Underlig bølgeadfærd kan forklare, hvorfor hvirvlen går i cirkler
- Microsoft afdækker mere russisk hacking forud for midterms
- Er det sandt, når du falder fra en gren til jorden nedenfor, trækker opad på jorden, hvis ja, hvo…


