Hvorfor bruger vi atomer eller mol i et laboratorium i det virkelige liv?
atomer er for små til at arbejde direkte:
* størrelse: Atomer er utroligt små (10^-10 meter). Vi kan ikke manipulere eller tælle dem individuelt.
* individuelle atomer er svære at studere: Det er ekstremt udfordrende at observere opførelsen af individuelle atomer.
mol er en praktisk måde at arbejde på med store numre:
* mængder i den virkelige verden: Kemiske reaktioner involverer milliarder og billioner af atomer. At arbejde med så massive tal ville være upraktisk.
* moler giver en bro: Molekonceptet (6.022 x 10^23 partikler) giver os mulighed for at relatere makroskopiske mængder (gram, liter) til den mikroskopiske verden af atomer og molekyler.
hvordan vi bruger dem i laboratoriet:
* massemålinger: Vi vejer reaktanter ved hjælp af gram eller milligram, som vi derefter kan konvertere til mol ved hjælp af molmasse.
* Koncentration: Opløsninger er ofte beskrevet med hensyn til molaritet (mol pr. Liter), hvilket giver os mulighed for at kontrollere mængden af reaktanter i en reaktion.
* Beregninger: Vi bruger molforhold fra afbalancerede kemiske ligninger til at forudsige mængderne af produkter, der er dannet i en reaktion.
Kortfattet: Mens atomer og mol er grundlæggende koncepter inden for kemi, håndterer vi dem ikke direkte i laboratoriet. I stedet bruger vi dem som værktøjer til forståelse og manipulering af kemiske reaktioner gennem målbare mængder som masse, volumen og koncentration.
 Varme artikler
Varme artikler
-
 Flydende krystaller skaber letlæselige, farveskiftende sensorerPME-forskere og ingeniører har udviklet en måde at strække og spænde flydende krystaller på for at generere forskellige farver. Dette kunne anvendes i smarte belægninger, sensorer, og bærbar elektroni
Flydende krystaller skaber letlæselige, farveskiftende sensorerPME-forskere og ingeniører har udviklet en måde at strække og spænde flydende krystaller på for at generere forskellige farver. Dette kunne anvendes i smarte belægninger, sensorer, og bærbar elektroni -
 Nyt lægemiddel kunne forhindre invaliderende bivirkning af kræftbehandlingPladsfyldende struktur skildring af GC4419 baseret på røntgenkrystalstrukturbestemmelse. Kredit:Dennis Riley Omkring 50, 000 mennesker i USA diagnosticeres årligt med hoved, nakke, kræft i næsen o
Nyt lægemiddel kunne forhindre invaliderende bivirkning af kræftbehandlingPladsfyldende struktur skildring af GC4419 baseret på røntgenkrystalstrukturbestemmelse. Kredit:Dennis Riley Omkring 50, 000 mennesker i USA diagnosticeres årligt med hoved, nakke, kræft i næsen o -
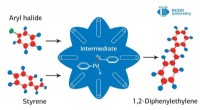 Kemiker udvikler blomsterlignende katalysatorer fra grafenKredit:RUDN University En RUDN -kemiker og kolleger fra Iran har udviklet en ny strategi til fremstilling af hule, porøse katalysatorer til Heck -koblingsreaktionen. Disse katalysatorer er kendete
Kemiker udvikler blomsterlignende katalysatorer fra grafenKredit:RUDN University En RUDN -kemiker og kolleger fra Iran har udviklet en ny strategi til fremstilling af hule, porøse katalysatorer til Heck -koblingsreaktionen. Disse katalysatorer er kendete -
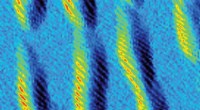 Polymerer klikker sammen ved hjælp af grøn kemiDisse fjederlignende strukturer er spiralformede polymerer. De spiralformede spoler er angivet med lyse striber i dette sidebillede af de små molekylestore tråde, der ligger på en overflade. Et team a
Polymerer klikker sammen ved hjælp af grøn kemiDisse fjederlignende strukturer er spiralformede polymerer. De spiralformede spoler er angivet med lyse striber i dette sidebillede af de små molekylestore tråde, der ligger på en overflade. Et team a
- Hvor lyd rejser i gas?
- Er det sandt, at for at en styrke skal flytte et objekt, skal der være to kræfter?
- Hvilken proces bruger celler, når de ikke har nok ilt til respiration?
- Nyt system sikrer sporbarhed i tekstilindustrien
- Hvordan tror du, at det at være en ikke -vaskulær plante påvirker mosens evne til at vokse høj?
- Højere energi, sikrere, længerevarende zinkbatteri:Forskere genopliver gammel kemi med ny elektrol…


