Er en brintbinding den stærkeste, der dannes mellem molekyler?
Her er en sammenbrud af intermolekylære kræfter fra svageste til stærkeste:
* van der Waals Forces: Dette er de svageste og stammer fra midlertidige udsving i elektronfordeling.
* London Dispersion Forces: Forekommer mellem alle molekyler, endda ikke -polære.
* dipol-dipol-kræfter: Forekommer mellem polære molekyler.
* Hydrogenbinding: Dette er en speciel type dipol-dipolinteraktion, hvor et hydrogenatom er bundet til et stærkt elektronegativt atom (som ilt, nitrogen eller fluor). Det er stærkere end typiske dipol-dipol-interaktioner.
* ioniske kræfter: Disse er meget stærkere end brintbindinger og er resultatet af elektrostatiske attraktioner mellem modsat ladede ioner.
Derfor er ioniske kræfter de stærkeste intermolekylære kræfter.
Mens hydrogenbindinger er stærkere end van der Waals -styrker, er de stadig markant svagere end ioniske kræfter.
Sidste artikelHvilken type atom repræsenterer kationer?
Næste artikelHvilken del af atomer producerede magnetisme?
 Varme artikler
Varme artikler
-
 Forsker udvikler metode til at ændre fundamental arkitektur af polymererAdjunkt Justin Kennemur og kandidatstuderende Taylor Isais er medforfattere på en ny undersøgelse om, hvordan man ændrer den grundlæggende struktur af en polymer. Kredit:Bruce Palmer/FSU Et forskn
Forsker udvikler metode til at ændre fundamental arkitektur af polymererAdjunkt Justin Kennemur og kandidatstuderende Taylor Isais er medforfattere på en ny undersøgelse om, hvordan man ændrer den grundlæggende struktur af en polymer. Kredit:Bruce Palmer/FSU Et forskn -
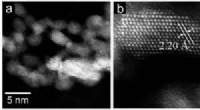 En rutheniumbaseret katalysator med højaktiv, flade overflader overgår metalbaserede konkurrenterAnalyse ved hjælp af højvinklet ringformet mørkfelt-scanningstransmissionselektronmikroskopi (HAADF-STEM) afslørede:(a) små og flade ruthenium-pletter over et stort domæne og (b) gitterafstanden svare
En rutheniumbaseret katalysator med højaktiv, flade overflader overgår metalbaserede konkurrenterAnalyse ved hjælp af højvinklet ringformet mørkfelt-scanningstransmissionselektronmikroskopi (HAADF-STEM) afslørede:(a) små og flade ruthenium-pletter over et stort domæne og (b) gitterafstanden svare -
 Elektrokemi skyller antibiotikaresistente proteiner udKredit:EPFL Alain Herzog /Yingdi Zhu, Horst Pick EPFL-forskere, arbejder i samarbejde med Valais Hospital i Sion og Fudan University i Shanghai, har udviklet en metode til at analysere bakterier,
Elektrokemi skyller antibiotikaresistente proteiner udKredit:EPFL Alain Herzog /Yingdi Zhu, Horst Pick EPFL-forskere, arbejder i samarbejde med Valais Hospital i Sion og Fudan University i Shanghai, har udviklet en metode til at analysere bakterier, -
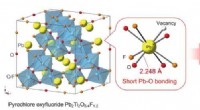 Forskere rapporterer om ny oxyfluoridforbindelse til fotokatalyseIndsatsen viser et billede af Pb 2 Ti 2 O 5 . 4 F 1 . 2 , vist at være i stand til at absorbere synligt lys med en bølgelængde på omkring 500 nm. Denne evne menes at skyldes bindingsstrukt
Forskere rapporterer om ny oxyfluoridforbindelse til fotokatalyseIndsatsen viser et billede af Pb 2 Ti 2 O 5 . 4 F 1 . 2 , vist at være i stand til at absorbere synligt lys med en bølgelængde på omkring 500 nm. Denne evne menes at skyldes bindingsstrukt
- Største stjerne i Mælkevejen?
- Hvad er den metode, der kan bruges til at skelne mellem svovlsyre og ethansyre?
- Kræft på Paleo-diæt? Spørg en, der levede for 1,7 millioner år siden
- Bor er en position til venstre for kulstof i det periodiske system. Atomnummeret 6. Givet dens tabel…
- Gamle vådområder giver et vindue til klimaændringer
- Hvad er de moderne rumfaciliteter og udstyr til at studere universet?


