Den molære opløselighed af påvirkes ikke af pH -opløsningen Na3PO4 NAF KNO3 ALCL3 eller MNS?
Forståelse af molær opløselighed og pH
* Molær opløselighed: Den molære opløselighed af et salt er koncentrationen af metalkationen (eller anion) i en mættet opløsning ved en given temperatur.
* ph: PH måler surhedsgraden eller grundlæggende af en opløsning.
hvordan ph påvirker opløselighed
PH af en opløsning kan påvirke opløseligheden af salte, der involverer svage syrer eller baser. Dette skyldes, at ligevægt af opløsningsreaktionen kan forskydes ved tilstedeværelsen af H+ eller OH-ioner.
analyse af salte
Lad os undersøge hvert salt:
* NA3PO4 (natriumphosphat): Fosfationer (PO43-) er den konjugerede base af en svag syre (H3PO4). I sure opløsninger reagerer H+ -ioner med PO43- for at danne H3PO4, hvilket skifter opløsnings-ligevægt til højre og øger opløseligheden. I basale løsninger vil OH-ioner have en minimal effekt på opløselighed.
* naf (natriumfluorid): Fluorioner (F-) er den konjugerede base af en svag syre (HF). I lighed med phosphat vil opløseligheden af NAF stige i sure opløsninger på grund af reaktionen af H+ med F-.
* KnO3 (kaliumnitrat): Nitrationer (NO3-) er den konjugerede base af en stærk syre (HNO3). Stærke syrer/baser påvirker ikke opløseligheden af deres konjugerede baser, så pH vil ikke påvirke opløseligheden af KNO3.
* alcl3 (aluminiumchlorid): Aluminiumchlorid involverer ikke en svag syre eller base. PH vil ikke påvirke dens opløselighed væsentligt.
* mns (mangan (II) sulfid): Sulfidioner (S2-) er den konjugerede base af en svag syre (H2S). Opløseligheden af MN'er vil stige i sure opløsninger på grund af reaktionen af H+ med S2-.
Konklusion
De salte, hvis molære opløselighed påvirkes af pH i opløsningen, er:
* NA3PO4 (natriumphosphat)
* NAF (natriumfluorid)
* mns (mangan (II) sulfid)
Vigtig note: Opløseligheden af disse salte vil stige i sure opløsninger og falde i grundlæggende opløsninger.
 Varme artikler
Varme artikler
-
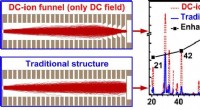 Forbedring af iontransmissionseffektiviteten af massespektrometreFokuseringseffekt af DC-ion-tragten. Kredit:Zhang Qiangling En nylig undersøgelse foretaget af forskere fra Hefei Institutes of Physical Science og offentliggjort i Analytical Chemistry præsenterer
Forbedring af iontransmissionseffektiviteten af massespektrometreFokuseringseffekt af DC-ion-tragten. Kredit:Zhang Qiangling En nylig undersøgelse foretaget af forskere fra Hefei Institutes of Physical Science og offentliggjort i Analytical Chemistry præsenterer -
 Forskere demonstrerer, hvordan man forbedrer stålegenskaberI Laboratoriet for højintensiv ionimplantation. Kredit:Tomsk Polytekniske Universitet Forskere fra Tomsk Polytechnic University har opdateret legeringsprocessen, dvs. at forbedre egenskaberne af m
Forskere demonstrerer, hvordan man forbedrer stålegenskaberI Laboratoriet for højintensiv ionimplantation. Kredit:Tomsk Polytekniske Universitet Forskere fra Tomsk Polytechnic University har opdateret legeringsprocessen, dvs. at forbedre egenskaberne af m -
 Superkondensatorer turboladet af afføringsmidlerSkematiske illustrationer af almindelige elektrolytter (til venstre) og ioniske flydende detergentlignende elektrolytter (til højre) på en elektrodeoverflade. Kredit:Xianwen Mao/Massachusetts Institut
Superkondensatorer turboladet af afføringsmidlerSkematiske illustrationer af almindelige elektrolytter (til venstre) og ioniske flydende detergentlignende elektrolytter (til højre) på en elektrodeoverflade. Kredit:Xianwen Mao/Massachusetts Institut -
 Silkemikrokokoner kunne bruges i bioteknologi og medicinSilkeormen spinder en silkekokon rundt om sig selv for at beskytte sig under metamorfosen. Forskere har fundet ud af, at silke kan beskytte andre dyrebare laster. Kredit:2017 Natural Materials Group
Silkemikrokokoner kunne bruges i bioteknologi og medicinSilkeormen spinder en silkekokon rundt om sig selv for at beskytte sig under metamorfosen. Forskere har fundet ud af, at silke kan beskytte andre dyrebare laster. Kredit:2017 Natural Materials Group


