Hvad er en ædel gas?
Her er hvad der gør dem til "ædel":
* Lav reaktivitet: Noble gasser har en fuld ydre skal af elektroner, hvilket gør dem ekstremt stabile og tilbageholdende med at danne kemiske bindinger med andre elementer.
* monatomisk: De findes som enkeltatomer, ikke molekyler.
* Fundet i spormængder i atmosfæren: Mens de er til stede i jordens atmosfære, findes de i meget små mængder.
Her er nogle nøgleegenskaber ved ædelgasser:
* farveløs og lugtfri: De er usynlige og har ingen lugt.
* Dårlige ledere af varme og elektricitet: De har lav termisk og elektrisk ledningsevne.
* lave kogepunkter: De har meget lave kogepunkter, hvilket betyder, at de findes som gasser ved stuetemperatur.
Eksempler på ædelgasser:
* Helium (han)
* Neon (NE)
* Argon (AR)
* Krypton (KR)
* Xenon (XE)
* Radon (RN)
Anvendelser af ædelgasser:
* helium: Brugt i balloner, dykketanke og som kølemiddel i MR -maskiner.
* neon: Brugt i neonskilte og lasere.
* Argon: Bruges til svejsning og som en afskærmningsgas i forskellige applikationer.
* krypton: Brugt i fluorescerende lys og lasere.
* xenon: Bruges i belysning med høj intensitet og som bedøvelsesmiddel.
* radon: Brugt i medicinsk billeddannelse og som radioaktiv sporstof.
Bemærk: De ædle gaselementer kaldes undertiden inerte gasser på grund af deres manglende reaktivitet. Imidlertid er dette udtryk ikke helt nøjagtigt, da nogle ædle gasser kan danne forbindelser under visse betingelser.
Sidste artikelHvad er antallet af gram i 4,56 mol H2O2?
Næste artikelHvad er den kemiske sammensætning af Skarn?
 Varme artikler
Varme artikler
-
 Forstå sprøde revner for at designe stærkere materialerKredit:CC0 Public Domain I et papir udgivet i Naturfysik , Northeastern University Department of Physics Arts and Sciences Distinguished Professor Alain Karma, i samarbejde med hans postdoktoral
Forstå sprøde revner for at designe stærkere materialerKredit:CC0 Public Domain I et papir udgivet i Naturfysik , Northeastern University Department of Physics Arts and Sciences Distinguished Professor Alain Karma, i samarbejde med hans postdoktoral -
 Bæredygtige sprøjtebetonblandingsdesign til tunneler med længere levetidAnvendelsen af sprøjtebeton er en af de vigtigste støtteforanstaltninger i tunnelbyggeriet. Kredit:ASSpC - TU Graz Levetiden for tunneler i dag er designet til at holde i mindst hundrede år -
Bæredygtige sprøjtebetonblandingsdesign til tunneler med længere levetidAnvendelsen af sprøjtebeton er en af de vigtigste støtteforanstaltninger i tunnelbyggeriet. Kredit:ASSpC - TU Graz Levetiden for tunneler i dag er designet til at holde i mindst hundrede år - -
 Hvordan positivt og negativt ladede ioner opfører sig ved grænsefladerForskere fra RUB og deres samarbejdspartnere har undersøgt, hvad der sker i grænsefladen mellem en vandig opløsning og en ladet overflade. Kredit:RUB, Kramer Hvordan positivt og negativt ladede ion
Hvordan positivt og negativt ladede ioner opfører sig ved grænsefladerForskere fra RUB og deres samarbejdspartnere har undersøgt, hvad der sker i grænsefladen mellem en vandig opløsning og en ladet overflade. Kredit:RUB, Kramer Hvordan positivt og negativt ladede ion -
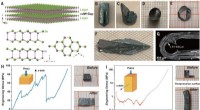 Forskere finder, at krystaller af indiumselenid har enestående fleksibilitetDeformerbarhed af InSe enkeltkrystaller. (A) Krystalstruktur af β-InSe og projektionen på (110) og (001) planerne. (B) Som-vokset krystal og (C) spaltningsoverflade. (D til F) InSe enkeltkrystal omdan
Forskere finder, at krystaller af indiumselenid har enestående fleksibilitetDeformerbarhed af InSe enkeltkrystaller. (A) Krystalstruktur af β-InSe og projektionen på (110) og (001) planerne. (B) Som-vokset krystal og (C) spaltningsoverflade. (D til F) InSe enkeltkrystal omdan


