Hvad betyder det at neutralisere i syrer og baser?
Her er en sammenbrud:
syrer: Syrer er stoffer, der frigiver hydrogenioner (H+), når de opløses i vand. De har en sur smag og kan blive blåt lakmuspapir rødt.
baser: Baser er stoffer, der frigiver hydroxidioner (OH-), når de opløses i vand. De har en bitter smag og kan blive rødt lakmuspapir blåt.
neutraliseringsreaktion:
Når en syre reagerer med en base, kombineres hydrogenionerne fra syren med hydroxidionerne fra basen for at danne vand (H2O). De resterende ioner danner et salt.
Eksempel:
* HCI (saltsyre) + NaOH (natriumhydroxid) → NaCl (natriumchlorid) + H2O (vand)
I dette eksempel reagerer saltsyre (HCI) med natriumhydroxid (NaOH). Hydrogenionerne (H+) fra HCI kombineres med hydroxidionerne (OH-) fra NaOH til dannelse af vand (H2O). De resterende ioner, natrium (Na+) og chlorid (Cl-), danner natriumchlorid (NaCl), som er et salt.
Nøglepunkter:
* ph -skala: PH -skalaen måler surhedsgraden eller alkaliniteten af en opløsning. En neutral opløsning har en pH på 7. Syrer har en pH mindre end 7, mens baser har en pH -værdi større end 7.
* neutraliseringsresultater: Neutraliseringsreaktioner producerer en opløsning med en pH tættere på 7, hvilket gør den mindre sur eller grundlæggende.
* applikationer: Neutraliseringsreaktioner bruges i mange anvendelser, herunder:
* fødevareproduktion: Neutralisering af overskydende syre i fødevarer.
* spildevandsbehandling: Neutraliserende sur eller grundlæggende spildevand.
* Lægemiddeludvikling: Neutraliserende sure eller grundlæggende lægemidler for at forbedre deres stabilitet og absorption.
Fortæl mig, hvis du gerne vil have flere detaljer om et specifikt aspekt af neutralisering!
 Varme artikler
Varme artikler
-
 Varme elektroner sender kuldioxid tilbage til fremtidenKatalysatornanopartiklerne udviklet af KAUST-forskere bruger lysenergi til at omdanne kuldioxid og brint til metan. Kredit:KAUST; Anastasia Serin Atmosfærisk kuldioxid (CO 2 ) er en væsentlig dr
Varme elektroner sender kuldioxid tilbage til fremtidenKatalysatornanopartiklerne udviklet af KAUST-forskere bruger lysenergi til at omdanne kuldioxid og brint til metan. Kredit:KAUST; Anastasia Serin Atmosfærisk kuldioxid (CO 2 ) er en væsentlig dr -
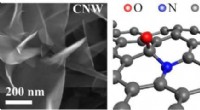 Alternativ til nitrogen:Oxygenplasma kan forbedre elektrodematerialers egenskaberSEM -billede af Carbon NanoWalls (CNW), en mulig position af ilt og nitrogen heteroatomer, cykliske voltammetri -kurver i sur elektrolyt. Kredit:Skolkovo Institute of Science and Technology En gru
Alternativ til nitrogen:Oxygenplasma kan forbedre elektrodematerialers egenskaberSEM -billede af Carbon NanoWalls (CNW), en mulig position af ilt og nitrogen heteroatomer, cykliske voltammetri -kurver i sur elektrolyt. Kredit:Skolkovo Institute of Science and Technology En gru -
 Vi komposterede bionedbrydelige balloner. Her er hvad vi fandt efter 16 ugerBionedbrydelige balloner efter 16 uger i ferskvand. Kredit:Jesse Benjamin, Forfatter angivet Efter 16 uger i en industriel kompostbunke, vi udgravede blå og hvide balloner og fandt dem helt uskadt
Vi komposterede bionedbrydelige balloner. Her er hvad vi fandt efter 16 ugerBionedbrydelige balloner efter 16 uger i ferskvand. Kredit:Jesse Benjamin, Forfatter angivet Efter 16 uger i en industriel kompostbunke, vi udgravede blå og hvide balloner og fandt dem helt uskadt -
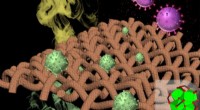 En sjælden bedrift:Materiale beskytter mod både biologiske og kemiske truslerProgrammerbar krystallinsk svamp-tekstil komposit til eliminering af biologiske og kemiske trusler. Kredit:Northwestern University Et forskningshold fra Northwestern University har udviklet et als
En sjælden bedrift:Materiale beskytter mod både biologiske og kemiske truslerProgrammerbar krystallinsk svamp-tekstil komposit til eliminering af biologiske og kemiske trusler. Kredit:Northwestern University Et forskningshold fra Northwestern University har udviklet et als
- Hvilket niveau af organisering er en gruppespilstrows ved havet?
- Forskning viser, at dyb lytning kan hjælpe med at bekæmpe klimaændringer
- Hvilken tilstand af stof har ikke et bestemt volumen eller form og udfører elektricitet?
- Er kogning en kemisk forandring eller psykisk forandring?
- Organiske materialer viser løfte om forbedret røntgenbilleddannelse
- Skjuler sig for et varmere klima i skoven


