Hvilken af følgende metaller er mest sandsynligt at danne flere forskellige positive ioner?
* Overgangsmetaller: Overgangsmetaller er kendt for at danne flere positive ioner (også kaldet oxidationstilstande). Dette skyldes, at de delvist har fyldt D -orbitaler, hvilket giver dem mulighed for at miste elektroner i forskellige kombinationer.
Lad os undersøge de muligheder, du leverede (du inkluderede ikke nogen specifikke metaller!).
For at bestemme svaret skal du kigge efter et overgangsmetal. Her er hvorfor:
* gruppe 1 og 2 metaller: Disse metaller (alkali og alkaliske jordmetaller) har en tendens til kun at danne en positiv ion. Gruppe 1 -formularer +1 -ioner og gruppe 2 -formularer +2 -ioner.
* ikke -metaller: Ikke -metaller danner typisk ikke positive ioner; De har en tendens til at få elektroner til at danne negative ioner.
Eksempel:
Lad os sige, at du har disse muligheder:
* natrium (NA): Gruppe 1 metal, former +1 ion.
* jern (Fe): Overgangsmetal, formularer +2 og +3 ioner.
* ilt (O): Ikke -metal, former -2 ion.
* calcium (CA): Gruppe 2 metal, former +2 ion.
I dette tilfælde jern (Fe) er mest sandsynligt at danne flere forskellige positive ioner.
Sidste artikelHvad er forskellen mellem ideel gaslov og kinetisk molekylær teori?
Næste artikelHvad er atomantal CI?
 Varme artikler
Varme artikler
-
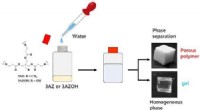 Tilføj bare vand:En simpel metode til at opnå alsidige porøse polymererForskere fra SIT, Japan, opdager, at tilsætning af vand til en triaziridinforbindelse ved milde temperaturer er nok til at producere stærke og konsistente porøse polymerer. Ved at justere reaktionstem
Tilføj bare vand:En simpel metode til at opnå alsidige porøse polymererForskere fra SIT, Japan, opdager, at tilsætning af vand til en triaziridinforbindelse ved milde temperaturer er nok til at producere stærke og konsistente porøse polymerer. Ved at justere reaktionstem -
 Forskere undersøger makrocykliske peptider som nye lægemiddelskabelonerNogle af disse molekyler kan krydse cellemembranen og kan åbne døre for nye lægemidler til i øjeblikket ubehandlede sygdomme. Kredit:Gwangju Institute of Science and Technology Takket være vores f
Forskere undersøger makrocykliske peptider som nye lægemiddelskabelonerNogle af disse molekyler kan krydse cellemembranen og kan åbne døre for nye lægemidler til i øjeblikket ubehandlede sygdomme. Kredit:Gwangju Institute of Science and Technology Takket være vores f -
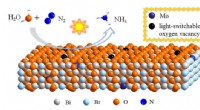 Forbedret omgivende ammoniakfotosyntese ved hjælp af nanosheets med lysomskiftelige iltpladserForskere har præsenteret en strategi ved samtidig at introducere lysomskiftelig ilt-ledighed og dopingmo i Bi 5 O 7 Br nanosheets til effektivt fotokatalytisk N 2 fiksering. Den modificerede fot
Forbedret omgivende ammoniakfotosyntese ved hjælp af nanosheets med lysomskiftelige iltpladserForskere har præsenteret en strategi ved samtidig at introducere lysomskiftelig ilt-ledighed og dopingmo i Bi 5 O 7 Br nanosheets til effektivt fotokatalytisk N 2 fiksering. Den modificerede fot -
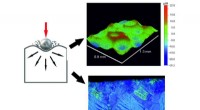 De seneste magnesiumundersøgelser baner vejen for nye biomedicinske materialerOverflademekanisk slidbehandling (SMAT) af magnesium forbedrer dets styrke og korrosionsbestandighed. Kredit:IFJ PAN Materialer anvendt i biomedicin skal karakteriseres ved kontrolleret bionedbryd
De seneste magnesiumundersøgelser baner vejen for nye biomedicinske materialerOverflademekanisk slidbehandling (SMAT) af magnesium forbedrer dets styrke og korrosionsbestandighed. Kredit:IFJ PAN Materialer anvendt i biomedicin skal karakteriseres ved kontrolleret bionedbryd


